
Wetenschap
Welke groep is uit alle zoutelementen het meest oplosbaar?
Dit is waarom:
* "zout" is een brede term: Het verwijst meestal naar ionische verbindingen gevormd door de reactie van een zuur en een basis.
* Oplosbaarheid hangt af van vele factoren: Deze omvatten de specifieke betrokken ionen, temperatuur en de aanwezigheid van andere stoffen in de oplossing.
We kunnen echter enkele generalisaties maken:
* Groep 1 (alkali -metalen) en groep 2 (alkalische aardmetalen) zouten over het algemeen meer oplosbaar zijn dan die van andere groepen. Dit komt omdat hun kationen (positief geladen ionen) kleiner zijn en lagere ladingen hebben, waardoor ze meer kans hebben op watermoleculen.
* Oplosbaarheid neemt af als u naar beneden gaat een groep. Dit komt omdat de kationen groter worden en minder aangetrokken worden tot de watermoleculen.
* Oplosbaarheid van zouten van een bepaald metaal kan sterk variëren. Natriumchloride (NaCl) is bijvoorbeeld zeer oplosbaar, terwijl zilverchloride (AGCL) vrijwel onoplosbaar is.
Om oplosbaarheidstrends te begrijpen, moet u rekening houden met de specifieke chemische eigenschappen van de betrokken ionen.
Samenvattend: Hoewel er algemene trends in oplosbaarheid zijn, is er geen enkele groep zoutelementen die universeel het meest oplosbaar zijn.
 Een nieuw mineraal uit de oudste vaste stoffen van het zonnestelsel in meteorieten
Een nieuw mineraal uit de oudste vaste stoffen van het zonnestelsel in meteorieten Een op de vier groene ruimten in Londen overschrijdt de veiligheidslimieten voor de luchtkwaliteit
Een op de vier groene ruimten in Londen overschrijdt de veiligheidslimieten voor de luchtkwaliteit Welke dingen in de buitenlucht bevatten koolstof?
Welke dingen in de buitenlucht bevatten koolstof?  Zal het langdurig exploiteren van aangelegde wetlands zelf een bron van vervuiling worden?
Zal het langdurig exploiteren van aangelegde wetlands zelf een bron van vervuiling worden?  Vissen profiteren als grote dammen een nieuwe manier van werken aannemen
Vissen profiteren als grote dammen een nieuwe manier van werken aannemen
Hoofdlijnen
- Wat is definitief in de wetenschap?
- Hoe heet ook interneuronen?
- Structuur die stoffen in de cel verpakt?
- Als je iets nieuwe kweekneuronen leert. Wat zou zeggen om deze verklaring te weerleggen?
- Wat is calclum?
- Hoe u een mRNA-reeks kunt berekenen
- Hoe schimmels voedingsstoffen beschikbaar maken voor de wereld
- Hoe kunnen mutaties de eiwitsynthese in cellen beïnvloeden? Wat is het resultaat?
- Wetenschappers ontdekken hoe rapamycine de celgroei vertraagt
- Organische afstandhouders verbeteren de LED-prestaties
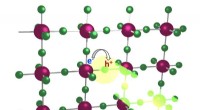
- Inzicht in de gasstroom voor verbeterde toepassingen voor schone energie

- Wetenschappers stellen nieuwe strategie voor elektrochemische reductie van kooldioxide voor
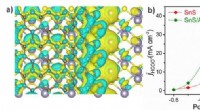
- Nieuwe hybride 3D-printtechniek voegt een vierde dimensie toe aan additive manufacturing

- Snelle en nauwkeurige meerkleurenbeeldvorming van biomoleculen nu mogelijk
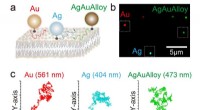
 Heeft de massa van de reagentia invloed op de snelheid van chemische reactie?
Heeft de massa van de reagentia invloed op de snelheid van chemische reactie?  Wat bevat grotere OH-ionen, een zuur of een base?
Wat bevat grotere OH-ionen, een zuur of een base?  Noem het petroleumproduct dat wordt gebruikt voor het opduiken van wegen?
Noem het petroleumproduct dat wordt gebruikt voor het opduiken van wegen?  Waarom verschijnen sterren 's nachts en geen dag?
Waarom verschijnen sterren 's nachts en geen dag?  8 van de beste wetenschappelijke boeken om te lezen deze zomer
8 van de beste wetenschappelijke boeken om te lezen deze zomer  Risicobeoordeling op nanoschaalniveau:de mimotoopvariatie-analyse nader bekeken
Risicobeoordeling op nanoschaalniveau:de mimotoopvariatie-analyse nader bekeken Wat u kunt doen om plasticvervuiling tegen te gaan
Wat u kunt doen om plasticvervuiling tegen te gaan Bruine ruis versus witte ruis:wat is het beste voor een goede nachtrust?
Bruine ruis versus witte ruis:wat is het beste voor een goede nachtrust?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

