
Wetenschap
Waarom hebben verschillende oplossingen van inhoud bij dezelfde temperatuur osmotische druk?
osmotische druk wordt aangedreven door het verschil in *opgeloste concentratie *, niet alleen de stof zelf.
* osmose is de beweging van oplosmiddel (meestal water) over een semipermeabiel membraan van een oppervlakte van hoge oplosmiddelconcentratie naar een oppervlakte van lage oplosmiddelconcentratie. Deze beweging wordt gedreven door de wens om de concentratie aan beide zijden van het membraan gelijk te maken.
* osmotische druk is de druk die moet worden uitgeoefend op de oplossing met de hogere opgeloste concentratie om de stroom van oplosmiddel over het membraan te voorkomen.
Hier is een uitsplitsing van hoe verschillende oplossingen van dezelfde stof verschillende osmotische druk kunnen hebben:
1. concentratie is belangrijk: Zelfs als de stof hetzelfde is, kan de concentratie van de opgeloste stof in elke oplossing variëren. Een hogere concentratie opgeloste stof betekent een lagere concentratie oplosmiddel, waardoor een groter osmotisch drukverschil ontstaat.
2. Dissociatie: Sommige stoffen, zoals zouten, dissociëren in ionen wanneer ze in water worden opgelost. Dit betekent dat een enkel molecuul zout kan bijdragen aan meerdere deeltjes in oplossing, wat leidt tot een hogere effectieve concentratie. NaCl dissocieert bijvoorbeeld in Na+ en clies, waardoor de deeltjesconcentratie effectief wordt verdubbeld in vergelijking met een niet-dissociatief molecuul.
Voorbeeld:
* Twee oplossingen van sucrose (suiker) bij dezelfde temperatuur, maar de ene is 1m (1 mol per liter) en de andere is 0,5 m zal verschillende osmotische druk hebben. De 1M -oplossing zal een hogere osmotische druk hebben omdat deze een hogere concentratie sucrosemoleculen heeft.
Samenvattend:
Hoewel de temperatuur constant is, is de sleutelfactor die osmotische druk bepaalt de concentratie van de opgeloste stof, rekening houdend met eventuele dissociatie -effecten.
 Leg uit wat wordt bedoeld met duurzame hulpbronnen?
Leg uit wat wordt bedoeld met duurzame hulpbronnen?  EU stemt ermee in de meeste plastics voor eenmalig gebruik te verbieden
EU stemt ermee in de meeste plastics voor eenmalig gebruik te verbieden Waarom volledige dammen geen waterveiligheid betekenen:een blik op Zuid-Afrika
Waarom volledige dammen geen waterveiligheid betekenen:een blik op Zuid-Afrika  Hoe onderzoek naar ‘klokken’ in planten ons leven kan veranderen
Hoe onderzoek naar ‘klokken’ in planten ons leven kan veranderen  Onderzoekers kunnen het bereik van mogelijke effecten van aan land vallende stormen beter kwantificeren
Onderzoekers kunnen het bereik van mogelijke effecten van aan land vallende stormen beter kwantificeren
Hoofdlijnen
- Mysterieus bodemvirusgen voor het eerst gezien
- Wat is de naam van enzym dat een ander enzym activeert?
- Komt een van de plasma -eiwitten in uw afkomstig van voedselproteïnen?
- Waarom hypnotiseert wetenschapper dat groene algen en planten een gemeenschappelijke voorouder delen?
- Wat vormt de darmmicrobioom van de bruine beren in Alaska? Locatie, locatie, locatie
- Wat draagt de stengel?
- Als een groep cellen niet genoeg ATP heeft, wat gebeurt er dan met het orgel?
- Stappen voor het succesvol telen van zoete aardappelen in Washington
- Wat is de heldere gelatineuze vloeistof in cellen?
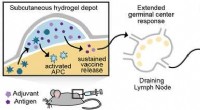
- Injecteerbare hydrogel kan ooit leiden tot effectievere vaccins
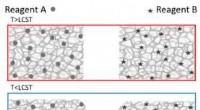
- Studie initieert chemische reacties door materialen te koelen in plaats van ze te verwarmen
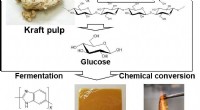
- De hoogste hittebestendige kunststof ooit is ontwikkeld uit biomassa
- Onderzoek naar met stikstof gedoteerde polycyclische aromatische koolwaterstoffen voor hoogwaardige OLED's

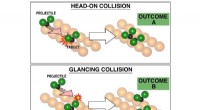
- Chemici bevorderen het vermogen om chemische reacties te beheersen
 Als het zee-ijs smelt, juveniele poolkabeljauw kan honger lijden
Als het zee-ijs smelt, juveniele poolkabeljauw kan honger lijden Wat zijn de tekenen van een exotherme reactie?
Wat zijn de tekenen van een exotherme reactie?  Socioloog adviseert waakzaamheid tegen evangelische spirituele strijders die erop uit zijn inheemse volkeren te bekeren
Socioloog adviseert waakzaamheid tegen evangelische spirituele strijders die erop uit zijn inheemse volkeren te bekeren Eigenschappen van staalsoorten
Eigenschappen van staalsoorten  Weer aan het werk gaan is net zo belangrijk als loskomen van het werk, studie vondsten
Weer aan het werk gaan is net zo belangrijk als loskomen van het werk, studie vondsten Nieuwe gepulseerde magneet onthult een nieuwe staat van materie in Kondo-isolator
Nieuwe gepulseerde magneet onthult een nieuwe staat van materie in Kondo-isolator Conversie van kubieke voet per uur naar BTUs
Conversie van kubieke voet per uur naar BTUs Californië gaat digitale rijbewijzen testen. Loopt persoonlijke informatie gevaar?
Californië gaat digitale rijbewijzen testen. Loopt persoonlijke informatie gevaar?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

