
Wetenschap
Waarom de oplosbaarheid van jodium in water toeneemt naarmate de concentratie kaliumjodide toeneemt?
Hier is een uitsplitsing:
1. jodium in water: Jodium (i 2 ) is slechts enigszins oplosbaar in water. Dit komt omdat jodium een niet -polair molecuul is en water een polair oplosmiddel is. De interactie tussen hen is zwak.
2. kaliumjodide: Kaliumjodide (ki) is oplosbaar in water, dissociërend in kaliumionen (k
+
) en jodide-ionen (i
-
).
3. Triiodide -ionenvorming: Wanneer jodium wordt toegevoegd aan een oplossing die jodide -ionen bevat, treedt een reactie op:
`` `
I 2 (aq) + i
-
(aq) ⇌ i 3
`` `
Het triiodide -ion (i 3
4 .'s principe van LE Chatelier: De vorming van triiodide -ionen is een evenwichtsreactie. Het verhogen van de concentratie van jodide -ionen (door meer ki toe te voegen) verschuift het evenwicht naar rechts, wat de vorming van meer triiodide -ionen bevordert.
5. Verhoogde oplosbaarheid: Naarmate er meer triiodide -ionen ontstaan, wordt meer jodium effectief "opgelost" in de oplossing, wat leidt tot een toename van de algehele oplosbaarheid van jodium.
Samenvattend: De aanwezigheid van jodide -ionen uit kaliumjodide bevordert de vorming van oplosbare triiodide -ionen, waardoor de oplosbaarheid van jodium in water effectief wordt verhoogd.
 Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen
Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen Welke twee structuren passeren water en mineralen om xyleem te krijgen?
Welke twee structuren passeren water en mineralen om xyleem te krijgen?  Onderzoekers boeken vooruitgang in ontziltingstechnologie
Onderzoekers boeken vooruitgang in ontziltingstechnologie Wat is het verschil tussen elektronische geometrie en moleculaire vorm?
Wat is het verschil tussen elektronische geometrie en moleculaire vorm?  Zelfrijdend, ui-achtige microvoertuigen kunnen aantrekken, val, en biologische bedreigingen te vernietigen
Zelfrijdend, ui-achtige microvoertuigen kunnen aantrekken, val, en biologische bedreigingen te vernietigen
 Voor het eerst kunnen we het hele jaar door de dikte van Arctisch zee-ijs meten
Voor het eerst kunnen we het hele jaar door de dikte van Arctisch zee-ijs meten Het gaat niet alleen om giftige chemicaliën:er werd ook radioactief afval gedumpt voor de kust van Los Angeles, concluderen wetenschappers
Het gaat niet alleen om giftige chemicaliën:er werd ook radioactief afval gedumpt voor de kust van Los Angeles, concluderen wetenschappers  Antarctische ijsmuren beschermen het klimaat
Antarctische ijsmuren beschermen het klimaat Water van plastic afval bevrijden met kwallenfilters
Water van plastic afval bevrijden met kwallenfilters De woedende bosbranden in Californië veroorzaken nog een dode
De woedende bosbranden in Californië veroorzaken nog een dode
Hoofdlijnen
- Niet-vasculaire plant: definitie, kenmerken, voordelen en voorbeelden
- Wat is de complementaire basispaarregel?
- Celwand: definitie, structuur en functie (met diagram)
- Nieuwe plantibodies zijn veelbelovend om citrus te beschermen tegen vergroeningsziekten
- In welk stadium van cellulaire ademhaling komen vetten -eiwitten en koolhydraten de metabolische route binnen?
- Hoe communiceren bacteriën?
- Op enig moment tijdens hun leven moeten alle cellen DNA bevatten. Is dit waar?
- Hoe noem je een wetenschapper die pompoenen bestudeert?
- Wetenschappers ontdekken hoe sommige bacteriën antibiotica overleven
- Een hoogwaardige nanopoederfaciliteit voor 3D-printen van metaal

- Robuust MOF-materiaal vertoont selectieve, volledig omkeerbare en herhaalbare opvang van giftig atmosferisch gas

- Kleine polymeerveren geven een boost aan het opruimen van het milieu
- Het creëren van energieneutrale huizen, niet-giftige glitter en fossielvrije lijm met hout

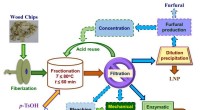
- Delignificatie van houtmonsters met p-tolueensulfonzuur als recyclebare hydrotroop
 Beschrijf het proces van bestuiving en bemesting in bloeiende planten
Beschrijf het proces van bestuiving en bemesting in bloeiende planten  Nylon 6-6 groener maken, en zonder zink
Nylon 6-6 groener maken, en zonder zink Review:Iedereen streamt Netflix, maar wat?
Review:Iedereen streamt Netflix, maar wat?  Kalksteen chemische componenten
Kalksteen chemische componenten  NASA ziet tropische storm Saola bij Guam
NASA ziet tropische storm Saola bij Guam Onderzoekers timen door plasmon gegenereerde elektronen die van nanostaafjes naar grafeen gaan
Onderzoekers timen door plasmon gegenereerde elektronen die van nanostaafjes naar grafeen gaan FRIPON-camera bovenop ESTEC
FRIPON-camera bovenop ESTEC Welke sterren zullen uit de Tarantulanevel komen? Het vliegende observatorium van NASA probeert erachter te komen
Welke sterren zullen uit de Tarantulanevel komen? Het vliegende observatorium van NASA probeert erachter te komen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

