
Wetenschap
Wat gebeurt er met een volume gas wanneer de temperatuur wordt verlaagd?
Dit is waarom:
* Kinetische moleculaire theorie: De kinetische moleculaire theorie stelt dat gasmoleculen in constante willekeurige beweging zijn en dat hun gemiddelde kinetische energie recht evenredig is met de absolute temperatuur.
* Verminderde temperatuur, verminderde kinetische energie: Wanneer de temperatuur daalt, neemt de gemiddelde kinetische energie van de gasmoleculen af. Dit betekent dat ze langzamer bewegen.
* minder botsingen: Langzamer moleculen botsen minder vaak met de wanden van de container.
* Verminderde druk: Verminderde botsingen betekenen dat minder druk op de containerwanden wordt uitgeoefend.
* Volume samentrekking: Om een constante druk te behouden, moet het volume van het gas afnemen om het verminderde aantal botsingen te compenseren.
Deze relatie tussen temperatuur en volume wordt samengevat door de wet van Charles :
v₁/t₁ =v₂/t₂
Waar:
* V₁ is het eerste volume
* T₁ is de begintemperatuur
* V₂ is het laatste deel
* T₂ is de eindtemperatuur
Belangrijke opmerking: Deze relatie geldt alleen als de druk en hoeveelheid gas constant blijven.
 Zijn de meerderheidselementen in het periodieke tabel genaamd een metalen of b metalloïden C niet-metalen?
Zijn de meerderheidselementen in het periodieke tabel genaamd een metalen of b metalloïden C niet-metalen?  Welk element gaan we vinden als gramiet in potlood?
Welk element gaan we vinden als gramiet in potlood?  Als je olie in een kopje water giet, zal het gif dan water geven?
Als je olie in een kopje water giet, zal het gif dan water geven?  Wetenschappers verbeteren de fietsprestaties van op Al gebaseerde batterijen met kathode met hoge oppervlaktedichtheid
Wetenschappers verbeteren de fietsprestaties van op Al gebaseerde batterijen met kathode met hoge oppervlaktedichtheid Onderzoekers ontwikkelen 3D-printbaar materiaal dat biologische weefsels nabootst
Onderzoekers ontwikkelen 3D-printbaar materiaal dat biologische weefsels nabootst
 Satellieten, supercomputers, en machine learning bieden realtime gegevens over het gewastype
Satellieten, supercomputers, en machine learning bieden realtime gegevens over het gewastype Gevolgen van overstromingen en droogtes nemen wereldwijd toe
Gevolgen van overstromingen en droogtes nemen wereldwijd toe De grootste bomen vangen de meeste koolstof op:grote bomen domineren de koolstofopslag in bossen
De grootste bomen vangen de meeste koolstof op:grote bomen domineren de koolstofopslag in bossen Minerale ontdekkingen op de Galapagos-eilanden vormen een puzzel over hun vorming en oorsprong
Minerale ontdekkingen op de Galapagos-eilanden vormen een puzzel over hun vorming en oorsprong Wat is een waterrijk gebied? Een ecoloog legt het uit
Wat is een waterrijk gebied? Een ecoloog legt het uit
Hoofdlijnen
- Welke drie omstandigheden zijn ideaal voor bacteriën om te groeien?
- Welke structuur leidt lucht van de luchtpijp naar secundaire bronchiën?
- Wat is FBS in laboratoriumtesten?
- Hoe worden onderling verbonden voedselketens genoemd?
- Wat zijn de biotechnologische producten?
- Wat is een bloeioloog?
- Behandeling voor honden verlicht de angst voor lawaaierig vuurwerk
- Wat is het belangrijkst voor het wetenschappelijke proces?
- Gestandaardiseerde metadata voor biologische monsters zouden het potentieel van collecties kunnen ontsluiten
- Germanium-lood perovskiet-LED's:een nieuwe manier om toxiciteit te verminderen

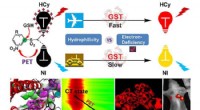
- Elektronendeficiëntie van fluorforen beïnvloedt de herkenningsprestaties van nabij-infrarood fluorescerende sondes
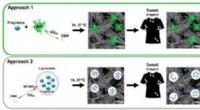
- De gevoeligheid van COVID-tests meten met nieuw materiaal van NIST
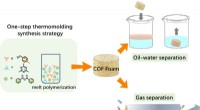
- Gebruik van smeltpolymerisatie om robuust covalent organisch raamwerkschuim te fabriceren
- Geurafgevende stof kan zweterige gymkleding helpen neutraliseren
 Wat geeft geel op de pH -schaal aan?
Wat geeft geel op de pH -schaal aan?  Hoe u een besluit kunt nemen over de voor- en nadelen van kernenergie
Hoe u een besluit kunt nemen over de voor- en nadelen van kernenergie Ziet RNA eruit als ladder in tweeën gesneden?
Ziet RNA eruit als ladder in tweeën gesneden?  Reuzenslakkenplan om Barrier Reef te redden
Reuzenslakkenplan om Barrier Reef te redden Klokkenluider Cambridge Analytica heeft volgende week afgeschreven
Klokkenluider Cambridge Analytica heeft volgende week afgeschreven Poreus, 3D-vormen van grafeen ontwikkeld aan het MIT kunnen 10 keer zo sterk zijn als staal, maar veel lichter
Poreus, 3D-vormen van grafeen ontwikkeld aan het MIT kunnen 10 keer zo sterk zijn als staal, maar veel lichter Onderzoekers ontwikkelen een nieuwe benadering van polarisatie-onafhankelijke LC-fasemodulatie
Onderzoekers ontwikkelen een nieuwe benadering van polarisatie-onafhankelijke LC-fasemodulatie  Verschillen tussen conceptuele onafhankelijke variabelen en operationele onafhankelijke variabelen
Verschillen tussen conceptuele onafhankelijke variabelen en operationele onafhankelijke variabelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

