
Wetenschap
Wat is het effect van oplosbare vluchtige stof op kookpunt een wateroplossing?
* dampdruk: Vluchtige stoffen hebben een hoge dampdruk, wat betekent dat ze gemakkelijk verdampen en bijdragen aan de totale dampdruk van de oplossing.
* kookpunt: Een oplossing kookt wanneer de dampdruk gelijk is aan de atmosferische druk. Hoe hoger de dampdruk van de oplossing, hoe lager de temperatuur waarmee deze kookt.
* de wet van Raoult: Deze wet stelt dat de dampdruk van een oplossing evenredig is met de molfractie van het oplosmiddel (water in dit geval). Wanneer een vluchtige opgeloste stof wordt toegevoegd, vermindert deze de molfractie van water, wat leidt tot een lagere dampdruk en dus een lager kookpunt.
Voorbeeld:
Het toevoegen van ethanol (een vluchtige stof) aan water zal het kookpunt van de resulterende oplossing verlagen. Dit komt omdat ethanol een hogere dampdruk heeft dan water. De aanwezigheid van ethanol verhoogt de totale dampdruk van de oplossing, waardoor deze bij een lagere temperatuur kookt.
Belangrijke opmerking: De mate waarin het kookpunt wordt verlaagd, hangt af van de concentratie en volatiliteit van de oplosbare vluchtige stof. Meer geconcentreerde oplossingen en meer vluchtige stoffen zullen een groter effect hebben op het kookpunt.
 Wetenschappers ontwikkelen een nieuw materiaal voor het manipuleren van moleculen
Wetenschappers ontwikkelen een nieuw materiaal voor het manipuleren van moleculen Superadsorberende MOF vangt tweemaal zijn gewicht op in water
Superadsorberende MOF vangt tweemaal zijn gewicht op in water Zijn de gassen op Saturnus gevaarlijk?
Zijn de gassen op Saturnus gevaarlijk?  DNA-schade veroorzaakt door migrerende lichtenergie
DNA-schade veroorzaakt door migrerende lichtenergie Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen
Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen
 Hoe schakelen gewas-veeteeltsystemen over op groene landbouwontwikkeling in het Baiyangdian Basin?
Hoe schakelen gewas-veeteeltsystemen over op groene landbouwontwikkeling in het Baiyangdian Basin?  Van materiële schade tot verloren productie:hoe natuurrampen de economie beïnvloeden
Van materiële schade tot verloren productie:hoe natuurrampen de economie beïnvloeden Op basis van een nieuw model, onderzoekers melden alarmerend polair smeltverschijnsel
Op basis van een nieuw model, onderzoekers melden alarmerend polair smeltverschijnsel Locals vluchten terwijl orkaanvaten worden versterkt richting het zuiden van de VS
Locals vluchten terwijl orkaanvaten worden versterkt richting het zuiden van de VS Wat zijn verschillen tussen planten en mensen?
Wat zijn verschillen tussen planten en mensen?
Hoofdlijnen
- Welke soorten plantencellen zijn er?
- Welk onderdeel van de biosfeer is een voorbeeld anorganische materie A. Suikers en NBSP B. Eiwitten C. Koolhydraten D. Mineralen?
- Uitsterven amfibieën leidt tot malariapiek in Latijns-Amerika
- Wat doodde de jonge walvissen? Nieuw onderzoek vindt een verdachte
- Wat is de vloeistof gevonden in mitochondria bekend als?
- Wat is een manier van ongeslachtelijke voortplanting?
- Het eten van insecten kan goed zijn voor de planeet. Europeanen zouden er meer van moeten eten
- Hoe is het schrijven geëvolueerd?
- Waarom gebruikte Mendel alle hoge planten in zijn F1 -experiment?
- Magnetische bacteriën als micropompen
- Schoner water door maïs
- Onderzoekers vinden een chemische oplossing om digitale gegevensopslag te verkleinen

- Een gemakkelijke weg naar polymeercoatings met potentieel gebruik bij het voorkomen van biofouling
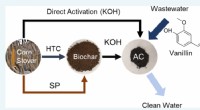
- Omringd door potentieel:nieuwe wetenschap bij het omzetten van biomassa
 Waarom is vloeibare HCL een slechte geleider van elektriciteit?
Waarom is vloeibare HCL een slechte geleider van elektriciteit?  Hoe het ecosysteem te beschermen
Hoe het ecosysteem te beschermen ALMA onthult de zon in nieuw licht
ALMA onthult de zon in nieuw licht Bij het opzetten van de dikte van een lijn wordt het gewicht genoemd en gemeten in?
Bij het opzetten van de dikte van een lijn wordt het gewicht genoemd en gemeten in?  Wat betekent neutraal bij het beschrijven van zuren en basen?
Wat betekent neutraal bij het beschrijven van zuren en basen?  Bioloog betwist conclusies van recente artikelen over biologisch magnetisme
Bioloog betwist conclusies van recente artikelen over biologisch magnetisme Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren
Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren Wat zijn de niet-Welke van deze is geen type chemische binding?
Wat zijn de niet-Welke van deze is geen type chemische binding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

