
Wetenschap
Waarom smelt tafelzout ijs sneller?
* Freezing Point Depression: Wanneer zout oplost in water, verstoren de natrium- en chloride -ionen de vorming van de normale ijskristalstructuur. Dit maakt het moeilijker voor watermoleculen om te bevriezen, waardoor het vriespunt wordt verlaagd.
* smelten, niet sneller smelten: In plaats van het smeltproces te versnellen, laat zout ijs smelten bij temperaturen onder het normale vriespunt. Dus, hoewel ijs niet kan smelten * sneller * met zout, zal het bij een lagere temperatuur smelten.
Hoe werkt dit in de praktijk?
* Zout op wegen: Zout wordt in de winter op wegen verspreid om het vriespunt van water te verlagen. Dit voorkomt dat ijs zich vormt of helpt het ijs te smelten, waardoor wegen veiliger worden voor reizen.
* Zout op trottoirs: Net als bij wegen helpt zout op trottoirs ijs te smelten en gladde omstandigheden te voorkomen.
belangrijke opmerkingen:
* geen magie: Zout maakt het niet op magische wijze dat ijs bij kamertemperatuur smelt. Het verlaagt eenvoudig het vriespunt.
* Effectiviteit: De effectiviteit van zout is afhankelijk van factoren zoals temperatuur en het type zout dat wordt gebruikt. Zeer koude temperaturen vereisen mogelijk verschillende soorten ontkoppelende middelen.
* milieuproblemen: Overmatig zoutgebruik kan negatieve milieueffecten hebben, zoals het schaden van planten en vervuilende waterwegen.
 Waarom kan een mengsel geen unieke chemische formule hebben?
Waarom kan een mengsel geen unieke chemische formule hebben?  Hoeveel elektronenparen bevinden zich in de buitenste schil van stikstof?
Hoeveel elektronenparen bevinden zich in de buitenste schil van stikstof?  Wat gebeurt er als je ammoniak en bakpoeder mengt?
Wat gebeurt er als je ammoniak en bakpoeder mengt?  Onderzoek naar stikstoffixatie kan licht werpen op biologisch mysterie
Onderzoek naar stikstoffixatie kan licht werpen op biologisch mysterie Metabolische activiteit van bruin vetweefsel gemakkelijker te verifiëren met nieuwe methode
Metabolische activiteit van bruin vetweefsel gemakkelijker te verifiëren met nieuwe methode
 Klimaatverandering zal waarschijnlijk dodelijker zijn in arme Afrikaanse nederzettingen
Klimaatverandering zal waarschijnlijk dodelijker zijn in arme Afrikaanse nederzettingen Wat betekent door veerkracht?
Wat betekent door veerkracht?  Onderzoekssamenwerking werkt in de richting van tijdige aanpassing aan kustoverstromingen
Onderzoekssamenwerking werkt in de richting van tijdige aanpassing aan kustoverstromingen Video's tonen vermeende ivoorsnavelspechten terwijl de VS op weg is naar een besluit tot uitsterven
Video's tonen vermeende ivoorsnavelspechten terwijl de VS op weg is naar een besluit tot uitsterven  Identificatie van Pacific Northwest Spiders
Identificatie van Pacific Northwest Spiders
Hoofdlijnen
- Hoeveel ziekten veroorzaakt door platwormen?
- Hebben alle cellen dezelfde samenstelling?
- Welk koninkrijk bevat eencellige organisims met een echte kern?
- Heeft glucose een transporteiwit nodig?
- Metagenomische analysesoftware onthult nieuwe oorzaken van het ontstaan van superbacteriën
- Wat is glucose en waarom het belangrijk is?
- Vijf soorten ecologische relaties
- Wat zijn gebieden waar celdeling gemakkelijk te zien is?
- Hoe visvinnen evolueerden vlak voor de overgang naar land
- Meegaan met de DNA-stroom:molecuul van het leven vindt nieuwe toepassingen in micro-elektronica

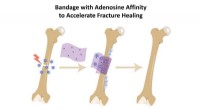
- Botverband neemt pro-genezende biochemische stoffen op om reparatie te versnellen
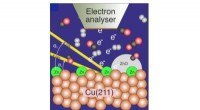
- Onderzoekers ontrafelen de actieve fase in katalytische reductie van kooldioxide tot methanol
- Kunsttong kan onderscheid maken tussen whisky's

- Springende hagedissen:onderzoek test de grenzen van gekko-adhesie

 Zorgt de recycling van ATP voor voortzetting glycolyse onder anaërobe omstandigheden?
Zorgt de recycling van ATP voor voortzetting glycolyse onder anaërobe omstandigheden?  Medische drones voor ongevallen en noodgevallen
Medische drones voor ongevallen en noodgevallen Radioactief afval:waar moet het naartoe?
Radioactief afval:waar moet het naartoe?  Rensselaer-team ontwikkelt tool om ruimtepuin te bestrijden
Rensselaer-team ontwikkelt tool om ruimtepuin te bestrijden Nieuwe metingen suggereren antineutrino anomalie gevoed door modelleringsfout
Nieuwe metingen suggereren antineutrino anomalie gevoed door modelleringsfout Wat is de Square Root-methode?
Wat is de Square Root-methode?  Wetenschappers zeggen dat vrijwillige emissiedoelstellingen van bedrijven niet voldoende zijn om echte klimaatactie te creëren
Wetenschappers zeggen dat vrijwillige emissiedoelstellingen van bedrijven niet voldoende zijn om echte klimaatactie te creëren  Investeren in kinderopvang levert talloze maatschappelijke en economische rendementen op
Investeren in kinderopvang levert talloze maatschappelijke en economische rendementen op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

