
Wetenschap
Welke oplosbaarheid van zout neemt toe met de temperatuur?
Dit is waarom:
* oplossen is een endotherme proces: Dit betekent dat het energie (meestal warmte) vereist om de bindingen te verbreken die de zoutionen in de vaste toestand houden en om ze te scheiden in individuele ionen in oplossing.
* LE Chatelier's principe: Wanneer u de temperatuur verhoogt, voegt u warmte toe aan het systeem. Het systeem zal verschuiven om die stress te verlichten, wat in dit geval betekent dat het endotherme proces van het oplossen van meer zout wordt verkregen.
Uitzonderingen:
* Sommige zouten vertonen ongewoon oplosbaarheidsgedrag: De oplosbaarheid van calciumsulfaat (CASO₄) bijvoorbeeld neemt af met toenemende temperatuur. Dit komt omdat de oplossing van calciumsulfaat een exotherme proces is en het toevoegen van warmte daadwerkelijk het evenwicht verschuift naar de vorming van vast calciumsulfaat.
Sleutelpunt: Hoewel de algemene regel is dat de oplosbaarheid in zout toeneemt met de temperatuur, is het altijd een goed idee om specifieke oplosbaarheidscurves op individuele zouten te controleren.
 Klimaatverandering kan leiden tot grotere atmosferische rivieren
Klimaatverandering kan leiden tot grotere atmosferische rivieren Verbeteringen in de kortetermijnvoorspelling van luchtverontreinigingsniveaus
Verbeteringen in de kortetermijnvoorspelling van luchtverontreinigingsniveaus Zwitserse glacioloog getuigt van meedogenloze smelting van gletsjers in de Alpen
Zwitserse glacioloog getuigt van meedogenloze smelting van gletsjers in de Alpen Onderzoek naar de gevolgen van klimaatverandering door middel van populaire spreekwoorden
Onderzoek naar de gevolgen van klimaatverandering door middel van populaire spreekwoorden Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten
Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten
Hoofdlijnen
- Wat zijn de voor- en nadelen van flowcytometrie?
- Wetenschappers duiken diep in hoe haaien de oceaan gebruiken
- Wetenschappers ontdekken de sleutel tot het beheersen van de ontwikkeling van stamcellen
- Kopiëren of innoveren? Studie werpt licht op de chimpanseecultuur
- Bewijs dat energiemetabolisme en regulatie van biofilmvorming in bacteriën met elkaar verweven zijn
- Wordt de cel gecreëerd door meiose identieke of andere oudercel?
- Hoe beïnvloedt fosforylatie eiwitactiviteit?
- Evolutionair celbiologisch onderzoek laat zien hoe de energieproductie kan worden geoptimaliseerd om snelle groei zonder ademhaling te garanderen
- Het oorsprongsverhaal van de baobab uitpakken
- Hydrogel coating is de eerste om ijsvorming op 3 verschillende manieren te voorkomen

- Onderzoekers versterken zwakste schakel in productie van sterke materialen
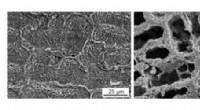
- Biomimetische hydrogel met fotodynamisch antimicrobieel effect
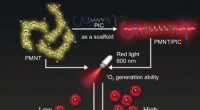
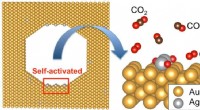
- Hoop op nieuwe katalysatoren met hoge activiteit
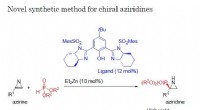
- Nieuwe chemische synthesemethode kan een opwindende reeks nieuwe verbindingen produceren
 De maan werpt een schaduw op aarde tijdens een?
De maan werpt een schaduw op aarde tijdens een?  Ontwikkeling van een nieuw medicijn tegen bloedkanker
Ontwikkeling van een nieuw medicijn tegen bloedkanker Brazils Embraer boekt nettoverlies voor 2018
Brazils Embraer boekt nettoverlies voor 2018 De routes van het Hanzetijdperk online onthullen
De routes van het Hanzetijdperk online onthullen Studie beschrijft cellulaire fabrieken in meer detail
Studie beschrijft cellulaire fabrieken in meer detail Regenwaterpraktijken in het Texas A&M AgriLife Dallas-centrum tonen een bredere belofte over de hele staat
Regenwaterpraktijken in het Texas A&M AgriLife Dallas-centrum tonen een bredere belofte over de hele staat  Hoe mosselen hun hechting onder water behouden
Hoe mosselen hun hechting onder water behouden Sluiting met microscopisch paddestoelontwerp belooft wat!
Sluiting met microscopisch paddestoelontwerp belooft wat!
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

