
Wetenschap
Wat is het verschil tussen een heterogene reactie en homogene reactie?
Homogene reactie:
* Alle reactanten en producten bevinden zich in dezelfde fase. Dit zou kunnen zijn:
* Alle gassen (bijv. De verbranding van methaan:ch₄ (g) + 2o₂ (g) → co₂ (g) + 2h₂o (g))
* Alle vloeistoffen (bijv. De reactie van ethanol en water:ch₃ch₂oh (l) + h₂o (l) → ch₃ch₂oh (aq))
* Alle vaste stoffen (bijv. De reactie van vast natrium en chloor:2NA (s) + Cl₂ (s) → 2Nacl (s))
* reactie treedt op in het hele mengsel. Er zijn geen duidelijke grenzen tussen reactanten.
* Over het algemeen sneller vanwege eenvoudiger mengen en interactie van moleculen.
heterogene reactie:
* reactanten en producten zijn in verschillende fasen. Dit zou kunnen zijn:
* Gas-vaste (bijv. Het verbranden van hout:C (s) + o₂ (g) → co₂ (g))
* Liquid-Solid (bijv. Het oplossen van suiker in water:C₁₂h₂₂o₁₁ (s) + H₂o (L) → C₁₂h₂₂o₁₁ (aq))
* Vloeistof-vloeistof (bijv. De extractie van olie uit sojabonen)
* Gas-vloeistof (bijv. De absorptie van koolstofdioxide in water:co₂ (g) + h₂o (l) → h₂co₃ (aq))
* reactie treedt alleen op bij het interface tussen de fasen. Dit creëert een oppervlakte -beperking.
* Over het algemeen langzamer Vanwege de noodzaak van moleculen om fasegrenzen te overwinnen om te interageren.
Hier is een tabel die de belangrijkste verschillen samenvat:
| Feature | Homogene reactie | Heterogene reactie |
| --- | --- | --- |
| fase | Alle reactanten en producten in dezelfde fase | Reactanten en producten in verschillende fasen |
| Reactielocatie | Over het hele mengsel | Op de interface tussen fasen |
| tarief | Over het algemeen sneller | Over het algemeen langzamer |
| voorbeelden | Verbranding van methaan, het oplossen van suiker in water | Verbranding van hout, het oplossen van calciumcarbonaat in zuur |
Het begrijpen van deze verschillen is cruciaal bij het voorspellen van reactiesnelheden, het ontwerpen van reactoren en het analyseren van chemische processen.
 Welke scheidingstechnieken zijn van toepassing op de boter-uit-wrongel?
Welke scheidingstechnieken zijn van toepassing op de boter-uit-wrongel?  Wetenschappers gebruiken katalysatoren om kankercellen van binnenuit te vernietigen
Wetenschappers gebruiken katalysatoren om kankercellen van binnenuit te vernietigen Video:Wat zijn forever chemicaliën, en gaan ze voor altijd mee?
Video:Wat zijn forever chemicaliën, en gaan ze voor altijd mee? Hoeveel elektronen zal een zwavelatoom winnen of verliezen om de edelgasstructuur te bereiken?
Hoeveel elektronen zal een zwavelatoom winnen of verliezen om de edelgasstructuur te bereiken?  Wetenschappers ontwikkelen een efficiënte manier om goedkope koellichamen te produceren
Wetenschappers ontwikkelen een efficiënte manier om goedkope koellichamen te produceren
Hoofdlijnen
- Haaien op de kaart zetten:een nieuwe standaard om belangrijke habitats te identificeren
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Kunnen we de capaciteiten van organismen imiteren om waterpatronen te decoderen voor nieuwe technologieën?
- Actine-onderzoek laat zien hoe vlindervleugels hun levendige kleuren krijgen
- Welke zou sneller mensen of bacteriën evolueren?
- Wie was de vader van taxonomie en hoe classificeerde hij levende organismen?
- Is het DNA tussen genen echt rommel?
- Wanneer ouderplanten worden gekruist, hoe verwijzen wetenschappers naar de eerste generatie nakomelingen?
- Team brengt in kaart hoe autofagie functioneert bij zoogdieren; SARS-CoV-2-infectie kan het proces verstoren
- Alles samenvoegen:inspiratie voor taaie en zelfherstellende materialen
- Nieuwe methode om kanker te bestrijden met moleculaire vezels
- Nieuwe lijm voor betere recycling

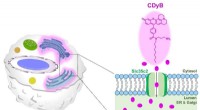
- Een eenvoudigere manier om B-cellen en T-cellen te differentiëren
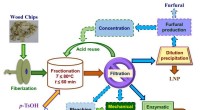
- Delignificatie van houtmonsters met p-tolueensulfonzuur als recyclebare hydrotroop
 Grote katten in Groot-Brittannië - stedelijke mythe of wetenschappelijk feit?
Grote katten in Groot-Brittannië - stedelijke mythe of wetenschappelijk feit? Wat zijn enkele veel voorkomende verbindingen van Technetium?
Wat zijn enkele veel voorkomende verbindingen van Technetium?  Een ander Higgs-gerucht herinnert ons eraan hoe wetenschap correct wordt bedreven
Een ander Higgs-gerucht herinnert ons eraan hoe wetenschap correct wordt bedreven  LHCb:Correlaties tonen nuances van het deeltjesgeboorteproces
LHCb:Correlaties tonen nuances van het deeltjesgeboorteproces  Kan de wereld de mondiale klimaatdoelstellingen halen zonder gecoördineerde actie?
Kan de wereld de mondiale klimaatdoelstellingen halen zonder gecoördineerde actie?  Wat is de definitie van bodemwater?
Wat is de definitie van bodemwater?  Koffiering-fenomeen uitgelegd in nieuwe theorie
Koffiering-fenomeen uitgelegd in nieuwe theorie Mega-carnivoor dinosaurus zwierf 200 miljoen jaar geleden door zuidelijk Afrika
Mega-carnivoor dinosaurus zwierf 200 miljoen jaar geleden door zuidelijk Afrika
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

