
Wetenschap
Wat zou het volume zijn in liters van 85,5 gram koolmonoxide?
Waarom temperatuur en druk is materie
Het volume van een gas is direct gerelateerd aan de temperatuur en druk. Hier is hoe:
* Temperatuur: Naarmate de temperatuur van een gas toeneemt, bewegen de moleculen sneller en verspreiden zich, waardoor het volume wordt verhoogd.
* Druk: Naarmate de druk op een gas toeneemt, worden de moleculen dichter bij elkaar geperst, waardoor het volume wordt verlaagd.
Het gebruik van de ideale gaswet
De ideale gaswet is de meest gebruikelijke manier om het volume, de druk, de temperatuur en de hoeveelheid gas te relateren. Het wordt uitgedrukt als:
pv =nrt
Waar:
* p =Druk (in atmosferen, atm)
* v =Volume (in liters, l)
* n =Aantal mol (mol)
* r =Ideale gasconstante (0,0821 L · atm/mol · k)
* t =Temperatuur (in Kelvin, K)
Hier is hoe het probleem op te lossen:
1. Bereken het aantal mol (N) van CO:
* Zoek de molaire massa van CO (12,01 g/mol voor C + 16,00 g/mol voor o =28,01 g/mol)
* Verdeel de massa van CO door de molaire massa:
* n =85,5 g / 28.01 g / mol =3,05 mol
2. U moet de temperatuur (t) en druk (p) van het koolmonoxidegas geven.
3. Oplossen voor volume (V):
* Herschik de ideale gaswet:V =(NRT) / P
* Sluit de waarden aan voor N, R, T en P.
Voorbeeld:
Laten we zeggen dat de temperatuur 25 ° C (298 K) is en de druk 1 atm is.
* V =(3,05 mol * 0,0821 l · atm / mol · k * 298 k) / 1 atm
* V ≈ 75.2 l
Daarom is het volume van 85,5 gram koolmonoxide bij 25 ° C en 1 atm ongeveer 75,2 liter.
Belangrijke opmerking: Vergeet niet om altijd de temperatuur en druk op te nemen wanneer u vraagt naar het volume van een gas.
 Maken ijzer en chloor ionische verbindingen?
Maken ijzer en chloor ionische verbindingen?  Wetenschappers gebruiken grote wetenschappelijke faciliteiten om de synthese en karakterisering van polymere stikstof te testen
Wetenschappers gebruiken grote wetenschappelijke faciliteiten om de synthese en karakterisering van polymere stikstof te testen  Russische wetenschappers ontwikkelden een sensor voor het detecteren van giftige stoffen in waterlichamen
Russische wetenschappers ontwikkelden een sensor voor het detecteren van giftige stoffen in waterlichamen Ultragevoelige transistor voor detectie van herbiciden in water
Ultragevoelige transistor voor detectie van herbiciden in water Wat is het verschil tussen organisch materiaal waaruit steenkool ontstaat en aardolie-aardgasvormen?
Wat is het verschil tussen organisch materiaal waaruit steenkool ontstaat en aardolie-aardgasvormen?
 Slechts 10 riviersystemen dragen tot 95 procent bij aan plastic in oceanen
Slechts 10 riviersystemen dragen tot 95 procent bij aan plastic in oceanen  Hoe reproduceert een madeliefje?
Hoe reproduceert een madeliefje?  Twee Korea's op scherp terwijl tyfoon schiereiland nadert
Twee Korea's op scherp terwijl tyfoon schiereiland nadert Verboden chemicaliën uit de jaren 70 gevonden in de diepste uithoeken van de oceaan
Verboden chemicaliën uit de jaren 70 gevonden in de diepste uithoeken van de oceaan Vragen over brandbestrijding terwijl Portugal in vuur en vlam vecht
Vragen over brandbestrijding terwijl Portugal in vuur en vlam vecht
Hoofdlijnen
- Onderzoekers ontdekken de onverwachte atomaire structuur van koude- en mentholsensor TRPM8
- Welk proces komt nooit voor in Intherphase?
- Slapen spinnen? Uit onderzoek blijkt dat ze net als mensen kunnen dutten
- Wat zijn enkele basistheorieën over de biologie?
- Waarom is het belangrijk voor wetenschappers om continu nieuwe vragen over voeding te stellen?
- Is er iemand? Menselijke embryo’s maken contact met aanstaande moeder
- De prehistorische meersteur is niet bedreigd, zeggen de VS, ondanks oproepen van natuurbeschermers
- Van 'boops' tot 'unks', hoe wetenschappers visgeluiden gebruiken om onderwaterecosystemen te behouden
- Hoe wordt genetische informatie van ouders tot nakomelingen overgedragen?
- Quasikristalhelder:materiaal onthult unieke verschuivende oppervlaktestructuur onder microscoop
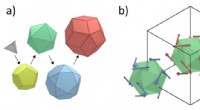
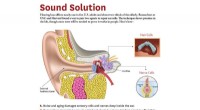
- Het verbinden van hoorhulpmoleculen met het oorbeen
- Wetenschappers stellen nieuw materiaal voor om oppervlakte-eigenschappen te wijzigen
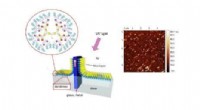
- Chemici leren hoe ze fenolen in gerookte voedselmonsters kunnen detecteren met behulp van vitamine B4

- Video:Waarom flamingo's cooler zijn dan je denkt

 Wat zijn de voordelen van biodiversiteit?
Wat zijn de voordelen van biodiversiteit?  Kan passie betere leraren maken en het slechte leerniveau van Indonesië genezen?
Kan passie betere leraren maken en het slechte leerniveau van Indonesië genezen?  Afval dat in Portman Bay wordt gedumpt, blijft 25 jaar later metalen in zee lozen
Afval dat in Portman Bay wordt gedumpt, blijft 25 jaar later metalen in zee lozen Hoe zien aurora’s eruit? | Hoe dingen werken
Hoe zien aurora’s eruit? | Hoe dingen werken  Akoestische beeldvorming onthult verborgen kenmerken van megathrust-fout voor Costa Rica
Akoestische beeldvorming onthult verborgen kenmerken van megathrust-fout voor Costa Rica NASA ziet overblijfselen van tropische cycloon Kenneth boven Noord-Mozambique
NASA ziet overblijfselen van tropische cycloon Kenneth boven Noord-Mozambique De effecten van de verwijdering van vast afval
De effecten van de verwijdering van vast afval Hoe bekritiseer je iets zonder een eikel te zijn?
Hoe bekritiseer je iets zonder een eikel te zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

