
Wetenschap
Wat is de druk in atmosferen van een 0,108 molmonster heliumgas bij temperatuur 20 Celsius als het volume 0,505L is?
Hier leest u hoe u de druk van het heliumgas kunt berekenen:
1. Convert Celsius naar Kelvin:
* Temperatuur (k) =temperatuur (° C) + 273.15
* Temperatuur (K) =20 ° C + 273.15 =293.15 K
2. Gebruik de ideale gaswet:
* De ideale gaswet is:PV =nrt
* P =druk (in atmosferen)
* V =volume (in liters)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (in kelvin)
3. Herschik de vergelijking om op te lossen voor P:
* P =(nrt) / v
4. Sluit de waarden aan:
* P =(0,108 mol * 0,0821 l · atm / mol · k * 293.15 k) / 0,505 l
5. Bereken de druk:
* P ≈ 5.24 ATM
Daarom is de druk van het heliumgas ongeveer 5,24 atmosferen.
 Wat is een subtropische storm en hoe verschilt deze van een tropisch of extratropisch systeem?
Wat is een subtropische storm en hoe verschilt deze van een tropisch of extratropisch systeem?  Neanderthalers:hoe een carnivoordieet tot hun ondergang heeft geleid
Neanderthalers:hoe een carnivoordieet tot hun ondergang heeft geleid  Nieuw-Zeelandse gletsjers krimpen
Nieuw-Zeelandse gletsjers krimpen Planten uit welke divisie zijn goed geschikt voor het levensleven?
Planten uit welke divisie zijn goed geschikt voor het levensleven?  Hoe breedtegraad en hoogte temperatuur beïnvloeden
Hoe breedtegraad en hoogte temperatuur beïnvloeden
Hoofdlijnen
- Orsini's adder:groei of voortplanting?
- Welke organellen helpen moleculen diffunderen over een membraan door transporteiwitten?
- Hoe cellen hun afval afvoeren
- Hoe een opkomende door teken overgedragen ziekteverwekker detectie ontwijkt
- Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Hoe maak je een celmodel van een Amoeba
- Wat zijn de vier organische moleculen die in levende wezens worden gevonden?
- Wat is DNA -splitsing?
- Hoe dinosaurusonderzoek de geneeskunde kan helpen
- Katalytische synthese van fenolen met lachgas
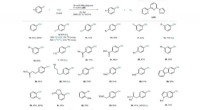
- Ongeneeslijk kankereiwit wordt medicamenteus, dankzij struik

- Onderzoekers stellen een strategie voor voor katalytische regiodivergente hydrosilylering van isopreen
- Onderzoekers ontwikkelen een toxinevrij lijmsysteem geïnspireerd op onderwaterwezens

- Een nieuw MXene-materiaal vertoont een buitengewoon afschermend vermogen tegen elektromagnetische interferentie

 Hoeveel ml in 2,5 cm?
Hoeveel ml in 2,5 cm?  Nieuw beeldvormingssysteem onthult defecten aan zonnepanelen, zelfs in fel zonlicht
Nieuw beeldvormingssysteem onthult defecten aan zonnepanelen, zelfs in fel zonlicht MUSE onderzoekt onbekende diepten van Hubble Ultra Deep Field
MUSE onderzoekt onbekende diepten van Hubble Ultra Deep Field Wat is de kracht die lift tegenwerkt?
Wat is de kracht die lift tegenwerkt?  Heeft snelle spin de ineenstorting van 2017 van neutronensterren in zwart gat vertraagd?
Heeft snelle spin de ineenstorting van 2017 van neutronensterren in zwart gat vertraagd? Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie
Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie Hoe kunnen wetenschappers onderscheid maken tussen een steen en een meteoriet?
Hoe kunnen wetenschappers onderscheid maken tussen een steen en een meteoriet?  Ruimtevaartuig dat uit zijn baan komt, klaar voor aanstaande testlancering
Ruimtevaartuig dat uit zijn baan komt, klaar voor aanstaande testlancering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

