
Wetenschap
Wat is het verschil tussen een exotherme chemische reactie en endotherme reactie?
Exotherme reacties:
* Release energie in de omgeving.
* Deze energie is meestal in de vorm van warmte , het maken van de omgeving warmer .
* Negatieve enthalpieverandering (ΔH) , wat betekent dat de producten minder energie hebben dan de reactanten.
* Voorbeelden:brandende brandstof, verbranding, neutralisatie van zuren en basen.
Endotherme reacties:
* Energie absorberen uit de omgeving.
* Deze energie wordt meestal genomen als warmte , het maken van de omgeving kouder .
* Positieve enthalpieverandering (ΔH) , wat betekent dat de producten meer energie hebben dan de reactanten.
* Voorbeelden:fotosynthese, smeltend ijs, verdampingswater.
Hier is een eenvoudige analogie:
* exotherme reactie: Als een vreugdevuur - het laat warmte vrij en maakt het gebied eromheen warmer.
* Endotherme reactie: Zoals een ijspak - het absorbeert warmte van je huid, waardoor het kouder aanvoelt.
Hier is een tabel die de verschillen samenvat:
| Feature | Exotherme reactie | Endothermische reactie |
| --- | --- | --- |
| Energietroom | Breng energie vrij | Absorbeert energie |
| Omgeving | Warmer | Kouder |
| Enthalpy Change (ΔH) | Negatief | Positief |
| Voorbeelden | Brandende brandstof, verbranding | Fotosynthese, smeltend ijs |
Vergeet niet dat of een reactie exotherme is of endotherm afhangt van de specifieke chemische reactie en de voorwaarden waaronder het plaatsvindt.
 Wat is de naam om groene planten wit te worden door gebrek aan licht?
Wat is de naam om groene planten wit te worden door gebrek aan licht?  Planetaire golven, afgesneden dieptepunten en blokkerende hoogtepunten:wat zit er achter recordoverstromingen op het zuidelijk halfrond?
Planetaire golven, afgesneden dieptepunten en blokkerende hoogtepunten:wat zit er achter recordoverstromingen op het zuidelijk halfrond? Wat is de toepassing van engineering op levende wezens?
Wat is de toepassing van engineering op levende wezens?  Hoe mensen steden en voorsteden waarnemen is niet louter een kwestie van grenslijnen
Hoe mensen steden en voorsteden waarnemen is niet louter een kwestie van grenslijnen  Leven in de vriezer:de revolutie die onze kijk op gletsjers voor altijd veranderde
Leven in de vriezer:de revolutie die onze kijk op gletsjers voor altijd veranderde
Hoofdlijnen
- Nieuwe technologie verandert de manier waarop eiwitten in individuele cellen worden bestudeerd
- Wat is een irisdiafragma in een microscoop?
- Mitochondria-afweer van dieren ontdekt in planten
- Drie soorten vezelig bindweefsel
- Hoe robots de productiecrisis van antibiotica kunnen oplossen
- Waar wordt de kern in de cel gevonden en waarom?
- Wat het doel van mitochondria in een cel?
- Welke van de divisies vaatplanten heeft meer leden?
- Natuurlijke stoffen zijn veelbelovend tegen het coronavirus
- Ontwikkeling van een nieuw, goedkoop apparaat voor de productie van galliumnitride (GaN) kristallen

- Het geheim van de plakkerigheid van mosselen onder water
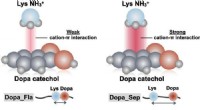
- Vloeibare kristalmonomeren die in LCD's worden gebruikt, bleken potentieel persistent en bioaccumulerend te zijn

- Chemische detectiechip ruikt cocaïne binnen enkele minuten
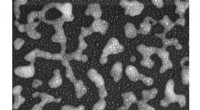
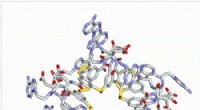
- Onderzoekers maken complexe molecule die spontaan vouwt als een eiwit
 Van landbouw tot fermentatie:hoe Nieuw-Zeeland nieuw voedsel zou kunnen 'brouwen' en de uitstoot van de landbouw zou kunnen verminderen
Van landbouw tot fermentatie:hoe Nieuw-Zeeland nieuw voedsel zou kunnen 'brouwen' en de uitstoot van de landbouw zou kunnen verminderen  Ontdekking van biomarkers in de ruimte:omstandigheden op Saturnusmaan Enceladus gesimuleerd in het laboratorium
Ontdekking van biomarkers in de ruimte:omstandigheden op Saturnusmaan Enceladus gesimuleerd in het laboratorium  Fracties uitvoeren op een TI-30X IIS
Fracties uitvoeren op een TI-30X IIS  Hoe een marginale kostenfunctie te vinden
Hoe een marginale kostenfunctie te vinden Wat is het belangrijkste doel van behoud?
Wat is het belangrijkste doel van behoud?  Onderzoekers zetten CO om in CO2 met een enkel metaalatoom
Onderzoekers zetten CO om in CO2 met een enkel metaalatoom Wat verklaart waarom koolstof zo’n veelzijdig element is?
Wat verklaart waarom koolstof zo’n veelzijdig element is?  Onderzoeksvraag:Hoe herken je een vervalsing?
Onderzoeksvraag:Hoe herken je een vervalsing?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

