
Wetenschap
Waarom brandend metaal betekent reactie met zuurstof?
* oxidatie: Dit is een chemisch proces waarbij een stof elektronen verliest.
* metalen: Metalen hebben de neiging om losjes elektronen in hun buitenschalen te hebben gehouden. Hierdoor wordt ze gemakkelijk beschikbaar om verloren te gaan tijdens chemische reacties.
* zuurstof: Zuurstof is een zeer elektronegatief element, wat betekent dat het sterk elektronen aantrekt.
Wanneer een metaal brandt:
1. Warmte: De warmte van het verbrandingsproces biedt de energie die nodig is om de reactie te starten.
2. zuurstof: Het metaal reageert met zuurstof in de lucht.
3. Elektronenoverdracht: De metaalatomen verliezen elektronen (oxidatie) en de zuurstofatomen krijgen elektronen. Dit vormt metaaloxide, dat meestal een vaste stof is.
4. Energieafgifte: Deze chemische reactie geeft energie vrij in de vorm van licht en warmte, die we beschouwen als het metaal "branden".
Voorbeeld:
* IJzeren branden: Wanneer ijzer brandt (roesten is een langzame vorm van branden), reageert het met zuurstof om ijzeroxide te vormen (roest). De chemische vergelijking is:
* 4fe + 3o₂ → 2fe₂o₃
Sleutelpunten:
* Brandende metalen is niet hetzelfde als brandende brandstoffen zoals hout of gas. Brandstoffen geven energie vrij van chemische bindingen, terwijl metalen energie vrijgeven door het verlies van elektronen.
* Niet alle metalen branden gemakkelijk. Sommige metalen, zoals goud en platina, zijn zeer bestand tegen oxidatie.
Laat het me weten als je meer details wilt over het oxidatieproces of de specifieke verbranding van verschillende metalen!
 Glucosebindend molecuul zou de behandeling van diabetes kunnen transformeren
Glucosebindend molecuul zou de behandeling van diabetes kunnen transformeren De lange en de korte van DNA-replicatie
De lange en de korte van DNA-replicatie Welke aanvullende informatie is nodig om de molecuulformule te berekenen op basis van het massapercentage van elk element in een verbinding?
Welke aanvullende informatie is nodig om de molecuulformule te berekenen op basis van het massapercentage van elk element in een verbinding?  Daalt de massa water af wanneer zout wordt toegevoegd?
Daalt de massa water af wanneer zout wordt toegevoegd?  Een nieuwe strategie voor een groener gebruik van calciumcarbide
Een nieuwe strategie voor een groener gebruik van calciumcarbide
Hoofdlijnen
- Welke celtypen blijven in niet-verdeeld stadium en voltooien het mitoseproces niet?
- Wereldprimeur gebruikt satellieten en oceaanmodellen om de biodiversiteit op de Antarctische zeebodem te verklaren
- Waar vind je DNA- en erfelijkheidsinformatie voor de cel?
- Eten kwetsbare leeuwen bedreigde zebra's?
- Team laat zien hoe vrouwelijke spinnen een actieve rol spelen bij de verkering
- Het gebruik van glowsticks in vallen verhoogt de vangst van amfibieën in studie aanzienlijk
- Is een rode bloedcel meer gespecialiseerd dan een amoeba of is het andersom uw antwoord uit te leggen?
- Indringende vraag:Wat is een neutrino?
- Dreigt voorgeschreven brand kwartelsnesten?
- Cascades met kooldioxide
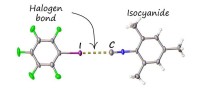
- Nieuwe niet-covalente binding blokkeert de afstotende geur van isocyaniden
- Oplichtende logica:ingenieurs voeren computationele logica uit met licht

- Team ontwikkelt snelle authenticatiemethode voor Chinese medicijnen

- Onderzoekers beschrijven structuren, mechanismen die bacteriën in staat stellen antibiotica te weerstaan

 Hoe verhoudt Soma zich tot de betekenissen van autosoom en somatische cellen?
Hoe verhoudt Soma zich tot de betekenissen van autosoom en somatische cellen?  Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?
Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?  Hoe ondersteunen macromoleculen de hogere trofische niveaus in een regenwoud?
Hoe ondersteunen macromoleculen de hogere trofische niveaus in een regenwoud?  Noem de landen in Afrika door welke evenaar voorbijgaat?
Noem de landen in Afrika door welke evenaar voorbijgaat?  Welke fenomenen is verantwoordelijk voor de vorming van de hoogste bergen?
Welke fenomenen is verantwoordelijk voor de vorming van de hoogste bergen?  Fossil plaatst uitgestorven sabeltandkat aan de kust van Texas
Fossil plaatst uitgestorven sabeltandkat aan de kust van Texas  Welke stad is 10s breedtegraad en 50W lengtegraad?
Welke stad is 10s breedtegraad en 50W lengtegraad?  In welke groep hebben alle atomen acht valentie -elektronen in de grondtoestand?
In welke groep hebben alle atomen acht valentie -elektronen in de grondtoestand?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

