
Wetenschap
Zijn atomen met meer dan 4 buitenste elektronen niet -metalen?
Waarom het over het algemeen waar is:
* elektronegativiteit: Niet -metalen hebben de neiging om een hoge elektronegativiteit te hebben, wat betekent dat ze elektronen sterk aantrekken. Atomen met meer dan 4 buitenste elektronen zijn dichter bij een volledig octet, waardoor ze meer enthousiast zijn om elektronen te krijgen en negatief geladen ionen te worden.
* binding: Niet -metalen vormen meestal covalente bindingen door elektronen te delen. Ze kunnen gemakkelijk een stabiel octet bereiken door elektronen te delen met andere niet -metalen.
Uitzonderingen op de regel:
* metalloïden: Metalloïden zoals silicium (SI) en Germanium (GE) hebben 4 buitenste elektronen en vertonen eigenschappen van zowel metalen als niet -metalen.
* overgangsmetalen: Overgangsmetalen hebben complexe elektronenconfiguraties en hun buitenste elektronentelling voorspellen niet altijd direct hun gedrag. Sommige overgangsmetalen kunnen meer dan 4 buitenste elektronen hebben, maar nog steeds metalen eigenschappen vertonen.
* waterstof: Waterstof heeft slechts 1 buitenste elektron en werkt als een niet -metaal, hoewel het slechts één meer elektron nodig heeft om een volledige schaal te bereiken.
Conclusie:
Hoewel de vuistregel nuttig is, is het belangrijk om te onthouden dat het aantal buitenste elektronen slechts één factor is die de eigenschappen van een element beïnvloedt. Andere factoren zoals elektronegativiteit, bindgedrag en zelfs positioneren op het periodiek systeem spelen een rol.
 Uit welke 3 deeltjes bestaat een atoom?
Uit welke 3 deeltjes bestaat een atoom?  Papier zonder microplastics:een economische en milieuvriendelijke coating
Papier zonder microplastics:een economische en milieuvriendelijke coating Is Pledge een zuur of een base?
Is Pledge een zuur of een base?  Je identificeert deze eenheden als glycerolmoleculen omdat de levercellen ze aan elkaar binden om zeer lang vertakte polymeren te vormen, hoe heet dat?
Je identificeert deze eenheden als glycerolmoleculen omdat de levercellen ze aan elkaar binden om zeer lang vertakte polymeren te vormen, hoe heet dat?  Activering van koolstof-fluorbindingen door samenwerking van een fotokatalysator en tin
Activering van koolstof-fluorbindingen door samenwerking van een fotokatalysator en tin
 Grond- en stroomwateraanwijzingen onthullen de impact van schalieboringen
Grond- en stroomwateraanwijzingen onthullen de impact van schalieboringen De geschiedenis van de aarde stuurt een klimaatwaarschuwing
De geschiedenis van de aarde stuurt een klimaatwaarschuwing China wordt geconfronteerd met aanzienlijk warmere zomers en winters in 2050
China wordt geconfronteerd met aanzienlijk warmere zomers en winters in 2050 De waterstanden in Lake Michigan zullen naar verwachting ruim onder de bijna historische hoogtepunten van 2020 blijven
De waterstanden in Lake Michigan zullen naar verwachting ruim onder de bijna historische hoogtepunten van 2020 blijven Klimaatverandering duwt Nieuw-Zeeland de warmste geregistreerde winter in
Klimaatverandering duwt Nieuw-Zeeland de warmste geregistreerde winter in
Hoofdlijnen
- Hoe communiceren vogels? Netwerkwetenschappelijke modellen openen nieuwe mogelijkheden voor experts
- Onderzoeker bespreekt de biologische overspraak tussen microben en gastheren
- Wat zat er achter het aardappeltekort in Australië? Nat weer en moeilijk te beheersen ziekten
- Welke eigenschap kan een menselijk nageslacht erven?
- Sleuteleiwit reguleert de immuunrespons op virussen in zoogdiercellen
- Verschil tussen bacterie- en plantencel Wall
- Waarom zijn cellen erg klein verklaren de beperkingengrootte van cellen?
- Welke fase van embryogenese in planten wordt gekenmerkt door de opslagreserves van de initiatieafzetting?
- Bacteriën zijn leden van welke koninkrijken?
- Nieuwe technologie voor enzymontwerp
- Zonnetoren stelt materialen bloot aan intense hitte om thermische respons te testen

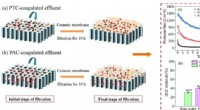
- Polytitaniumchloride pre-coagulatie voor vervuilingscontrole van keramisch membraan
- Economische synthese van polyacrylaten en polymethacrylaten uit biobased materialen
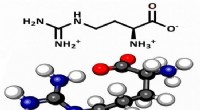
- Onderzoekers ontdekken dat het aminozuur arginine mogelijk een belangrijkere rol heeft gespeeld in de chemische oorsprong van het leven
 Contact met spermadonoren roept veel emoties op bij volwassen nakomelingen
Contact met spermadonoren roept veel emoties op bij volwassen nakomelingen Waarom worden algoritmen algoritmen genoemd? Een korte geschiedenis van de Perzische polymath waar je waarschijnlijk nog nooit van hebt gehoord
Waarom worden algoritmen algoritmen genoemd? Een korte geschiedenis van de Perzische polymath waar je waarschijnlijk nog nooit van hebt gehoord  De rol van tijgers in het ecosysteem
De rol van tijgers in het ecosysteem Wanneer een stof uitbreidt, wat gebeurt er met zijn massa?
Wanneer een stof uitbreidt, wat gebeurt er met zijn massa?  Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden
Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden Het grote structurele voordeel Eukaryoten hebben over prokaryoten
Het grote structurele voordeel Eukaryoten hebben over prokaryoten  Producenten van biologische sojabonen kunnen concurrerend zijn met weinig of geen grondbewerking
Producenten van biologische sojabonen kunnen concurrerend zijn met weinig of geen grondbewerking Afbraak van polystyreen in de oceaan - vervuiling op wereldschaal
Afbraak van polystyreen in de oceaan - vervuiling op wereldschaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

