
Wetenschap
Waarom is de geleidbaarheid van gezuiverd water niet nul?
Hier is een uitsplitsing:
* Watermoleculen zijn niet altijd stabiel: Watermoleculen (H₂o) kunnen spontaan dissociëren in waterstofionen (H⁺) en hydroxide -ionen (OH⁻):
* H₂o ⇌ H⁺ + oh⁻
* evenwicht: Deze reactie is in evenwicht, wat betekent dat het constant heen en weer gaat.
* Zeer kleine concentratie ionen: Hoewel de auto-ionisatie een zeer klein percentage is, creëert het nog steeds een kleine hoeveelheid vrije ionen. Bij 25 ° C is de concentratie van H⁺ en OH⁻ -ionen ongeveer 10⁻⁷ mol/L.
* ionen laten geleidbaarheid toe: Deze vrije ionen kunnen een elektrische stroom dragen, waardoor zelfs zeer gezuiverd water enigszins geleidend is.
factoren die de geleidbaarheid beïnvloeden:
* Temperatuur: Hogere temperaturen verhogen de snelheid van auto-ionisatie, wat leidt tot hogere geleidbaarheid.
* Opgeloste onzuiverheden: Zelfs sporenhoeveelheden onzuiverheden zoals zouten of zuren kunnen de geleidbaarheid aanzienlijk verhogen door meer ionen aan de oplossing toe te voegen.
Samenvattend:
De auto-ionisatie van water, hoewel een zeer klein proces, creëert een kleine hoeveelheid ionen die gezuiverd water enigszins geleidend maken. De geleidbaarheid is nog steeds erg laag in vergelijking met andere oplossingen, maar niet volledig nul.
 Antarctische bodemwateren verfrissen in een onverwacht tempo
Antarctische bodemwateren verfrissen in een onverwacht tempo Nieuwe peiling onthult publieke ontkoppeling over voedsel en klimaatverandering
Nieuwe peiling onthult publieke ontkoppeling over voedsel en klimaatverandering Waarom wordt steenkool ondergrondse zonneschijn genoemd?
Waarom wordt steenkool ondergrondse zonneschijn genoemd?  Niet te rechtvaardigen:nieuw rapport laat zien hoe de gasexpansie van de natie Australiërs in gevaar brengt
Niet te rechtvaardigen:nieuw rapport laat zien hoe de gasexpansie van de natie Australiërs in gevaar brengt De groei van grote steden escaleert de kloof tussen stad en platteland
De groei van grote steden escaleert de kloof tussen stad en platteland
Hoofdlijnen
- Onderzoek ontrafelt het mysterie van hoe vroege dieren de ijstijd overleefden
- Waar staat Lab in de term wetenschap voor?
- Hoeveel Valence-elektronen heeft natrium?
- Welk hormoon is betrokken bij het handhaven van de wateropname?
- Genetisch gemodificeerde gist levert intense hoparoma's op in bier, blijkt uit onderzoek
- Droogte geen dingo's achter het uitsterven van tijgers op het vasteland van Australië:studie
- Hoe brengen planten microbiële vrienden en vijanden in evenwicht?
- Hoe DNA en een supercomputer kunnen helpen de honingbijpopulaties in stand te houden
- Professor forensisch onderzoek onderzoekt nieuwe technologie om DNA-detectie te verbeteren
- Een materiaal met een bijzondere twist:2-D molybdeendiselenidekristal

- Kijken hoe een covalent polymeer zich ontwikkelt met behulp van een scanning tunneling microscoop

- Onderzoekers beoordelen gebruik, fytochemie en farmacologische eigenschappen van het geslacht Blechnum
- Zelfherstellend cement kan de geothermische industrie transformeren

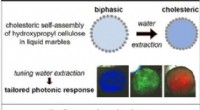
- Zelfassemblage van responsieve fotonische biobased materialen in vloeibare knikkers
 Onderzoekers identificeren een metaal dat bestand is tegen ultrahoge temperatuur en druk
Onderzoekers identificeren een metaal dat bestand is tegen ultrahoge temperatuur en druk Evacuatiebesluitvorming:hoe mensen keuzes maken bij rampen
Evacuatiebesluitvorming:hoe mensen keuzes maken bij rampen  Zijn hun vulkanen in Mississippi?
Zijn hun vulkanen in Mississippi?  Nieuw single-cell nanoporie-sequencing-instrument versnelt de analyse van tumorcellen
Nieuw single-cell nanoporie-sequencing-instrument versnelt de analyse van tumorcellen  Welke energie wordt opgeslagen in het midden van atomen?
Welke energie wordt opgeslagen in het midden van atomen?  Koolstofverhoudingen van tonijn onthullen verschuiving in voedselweb
Koolstofverhoudingen van tonijn onthullen verschuiving in voedselweb Welk systeem regelt de ademhaling?
Welk systeem regelt de ademhaling?  Een nieuwe manier om medicijnen af te leveren met nauwkeurige targeting
Een nieuwe manier om medicijnen af te leveren met nauwkeurige targeting
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

