
Wetenschap
Is lithium of neon reactiever?
Redenen:
* Elektronenconfiguratie: Lithium heeft een enkele valentie -elektron in zijn buitenste schaal, terwijl Neon een volledig octet (8 elektronen) heeft in de buitenste schaal. Dit betekent dat lithium gemakkelijk zijn valentie -elektron verliest om een stabiele configuratie te bereiken, terwijl neon zeer stabiel en terughoudend is om elektronen te winnen of te verliezen.
* ionisatie -energie: Lithium heeft een relatief lage ionisatie -energie, wat betekent dat het minder energie vereist om zijn valentie -elektron te verwijderen. Neon daarentegen heeft een zeer hoge ionisatie -energie, waardoor het extreem moeilijk is om een elektron te verwijderen.
* elektronegativiteit: Lithium heeft een lage elektronegativiteit, wat betekent dat het de neiging heeft om elektronen te verliezen. Neon heeft een zeer hoge elektronegativiteit, waardoor het onwaarschijnlijk is dat het elektronen krijgt.
Reactiviteit:
* Lithium is een zeer reactief alkalimetaal dat gemakkelijk reageert met water, lucht en zuren.
* Neon is een edelgas dat extreem niet -reactief is en geen chemische bindingen vormt onder normale omstandigheden.
Conclusie:
Vanwege de elektronenconfiguratie, ionisatie -energie en elektronegativiteit is lithium aanzienlijk reactiever dan neon. De stabiele elektronenconfiguratie van Neon maakt het praktisch inert.
 Storing afvalwaterzuiveringsinstallatie Warschau vervuilt rivier Wisla
Storing afvalwaterzuiveringsinstallatie Warschau vervuilt rivier Wisla Wereldwijde tol door aardverschuivingen is het zwaarst in ontwikkelingslanden
Wereldwijde tol door aardverschuivingen is het zwaarst in ontwikkelingslanden VN waarschuwt voor paradigmaverschuiving die nodig is om wereldwijde klimaatchaos te voorkomen
VN waarschuwt voor paradigmaverschuiving die nodig is om wereldwijde klimaatchaos te voorkomen Afbeelding:Antarctische onderzoeksbasis Concordia
Afbeelding:Antarctische onderzoeksbasis Concordia Hoe zich te ontdoen van Salamanders
Hoe zich te ontdoen van Salamanders
Hoofdlijnen
- Wat is biologisch zelf?
- Hoe glow-in-the-dark-kwallen een revolutie teweegbrachten in de plantenbiologie
- Zeebacteriën werken samen om een essentiële vitamine te produceren
- Welke organel vangt energie uit zonlicht en gebruikt het om voedsel voor de cel te produceren?
- Hoe gebruikt plaque suiker?
- Wat maakt voedsel voor een plant 4 letters?
- Wat zijn de gevallen van toevallige ontdekking in de biologie?
- Nieuwe analyse van oude vissen kan verklaren hoe de schouder is geëvolueerd
- Wat is intact organisme?
- Kunstmatige intelligentie identificeert optimale materiaalformule

- Innovatiepioniers scoren wereldprimeur voor duurzaam bouwen met grafeenbeton

- Onderzoeksbevinding kan het energieverbruik en de kosten bij het maken van silicium verlagen

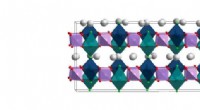
- Oprukkende meervoudige legeringen:onderzoekers verkennen nieuwe domeinen van compositorisch complexe metalen
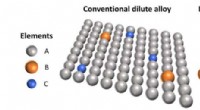
- Nieuwe genomische methode onthult atomaire rangschikkingen van batterijmateriaal
 Einde van gigantische ijsberg A-68
Einde van gigantische ijsberg A-68 Microplastics hopen zich op in hotspots voor diepzeeleven
Microplastics hopen zich op in hotspots voor diepzeeleven Op weg naar de volgende generatie op moleculen gebaseerde magneten
Op weg naar de volgende generatie op moleculen gebaseerde magneten Welk metaal is het meest reactief met zoutzuur uit magnesium en koper?
Welk metaal is het meest reactief met zoutzuur uit magnesium en koper?  Apparaat genereert UV-spectrumlaserpulsen met een recordbrekende efficiëntie
Apparaat genereert UV-spectrumlaserpulsen met een recordbrekende efficiëntie Door aerosol ondersteunde biosynthesestrategie maakt functionele bulk-nanocomposieten mogelijk
Door aerosol ondersteunde biosynthesestrategie maakt functionele bulk-nanocomposieten mogelijk Waarom de deal tussen Pokemon en McDonald's in Japan groot zou kunnen zijn
Waarom de deal tussen Pokemon en McDonald's in Japan groot zou kunnen zijn  Transparante elektrode-innovatie kan flexibele zonnecellen opleveren, transistoren, displays
Transparante elektrode-innovatie kan flexibele zonnecellen opleveren, transistoren, displays
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

