
Wetenschap
Is de atomaire massa -eenheid gelijk aan één mol van een stof?
Dit is waarom:
* Atomic Mass Unit (AMU): De AMU is een zeer kleine massa -eenheid die wordt gebruikt om de massa atomen en moleculen uit te drukken. Het wordt gedefinieerd als 1/12e de massa van een koolstof-12-atoom.
* mol: Een mol is een eenheid van een hoeveelheid substantie. Het vertegenwoordigt een specifiek aantal deeltjes (atomen, moleculen, enz.). Eén mol bevat 6,022 x 10^23 deeltjes (het nummer van Avogadro).
Relatie tussen AMU en Mole:
* De atomaire massa van een element in AMU is numeriek gelijk aan de molaire massa van dat element in gram per mol (g/mol).
* Bijvoorbeeld, de atoommassa van koolstof is 12 AMU en de molaire massa is 12 g/mol.
Samenvattend:
* De atomaire massa -eenheid is een massa -eenheid, terwijl de mol een eenheid van hoeveelheid is.
* Hoewel ze gerelateerd zijn door het concept van molaire massa, zijn ze niet gelijk.
 Waarom kan een katalysator de reactie versnellen, zelfs bij lage temperatuur?
Waarom kan een katalysator de reactie versnellen, zelfs bij lage temperatuur?  Wat is directe titratie?
Wat is directe titratie?  Onderzoekers gebruiken jiggly Jell-O om krachtige nieuwe waterstofbrandstofkatalysator te maken
Onderzoekers gebruiken jiggly Jell-O om krachtige nieuwe waterstofbrandstofkatalysator te maken Wat zijn enkele toepassingen van metalloïden?
Wat zijn enkele toepassingen van metalloïden?  Tekenen van burn-out kunnen worden gedetecteerd in zweet
Tekenen van burn-out kunnen worden gedetecteerd in zweet
 Onderzoekers identificeren het molecuul dat verantwoordelijk is voor een krachtig carcinogeen dat wordt aangetroffen in gerecycled afvalwater
Onderzoekers identificeren het molecuul dat verantwoordelijk is voor een krachtig carcinogeen dat wordt aangetroffen in gerecycled afvalwater Sinabung-vulkaan in Indonesië ontketent torenhoge askolom
Sinabung-vulkaan in Indonesië ontketent torenhoge askolom Verschillen tussen vijvers en oceanen voor kleuters
Verschillen tussen vijvers en oceanen voor kleuters NASA-studie daagt lang gekoesterde tsunami-vormingstheorie uit
NASA-studie daagt lang gekoesterde tsunami-vormingstheorie uit Zeeschelpen in Alaska onthullen een veranderend noordpoolgebied
Zeeschelpen in Alaska onthullen een veranderend noordpoolgebied
Hoofdlijnen
- Nieuw onderzoek onderzoekt hoe ziekten zich verspreiden bij primaten
- In welk stadium brengt eukaryotische cellen het grootste deel van hun celcyclus uit?
- Wat betekent spore-vormende?
- Cameravallen en andere goedkope gegevensbronnen vormen de basis voor ecologiestudies en inspanningen voor natuurbehoud
- Onderzoek ontrafelt het mysterie van hoe vroege dieren de ijstijd overleefden
- Een korte definitie voor wetenschappelijke methode?
- Hoe de echidna zijn gif verloor
- Interferentie berekenen
- Verdeel en definieer:aanwijzingen om te begrijpen hoe stamcellen verschillende soorten produceren
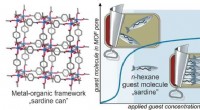
- Gastuitlijning en defectvorming tijdens porievulling in metaal-organische raamwerkfilms
- Onderzoekers identificeren enzym dat verantwoordelijk is voor de verspreiding van kankertumoren

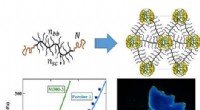
- Polymeren die kameleonhuid nabootsen
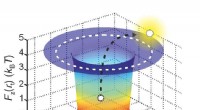
- De eerste nauwkeurige meting van de effectieve lading van een enkele molecule
- Nieuwe katalysator voor het maken van brandstoffen uit schaliegas

 Japanse studenten gebruiken VR om bombardementen op Hiroshima na te bootsen
Japanse studenten gebruiken VR om bombardementen op Hiroshima na te bootsen Nieuwe benadering voor het testen van gezondheid, milieueffecten van nanodeeltjes
Nieuwe benadering voor het testen van gezondheid, milieueffecten van nanodeeltjes Uit onderzoek blijkt dat de opwarming van de diepzeewateren in Antarctica bijdraagt aan de stijging van de zeespiegel in de Noord-Atlantische Oceaan
Uit onderzoek blijkt dat de opwarming van de diepzeewateren in Antarctica bijdraagt aan de stijging van de zeespiegel in de Noord-Atlantische Oceaan  Nieuw onderzoek toont aan dat racisme tijdens COVID zelden wordt gemeld
Nieuw onderzoek toont aan dat racisme tijdens COVID zelden wordt gemeld Grondwatermarkten kunnen oplossingen voor de waterproblemen van het Westen promoten
Grondwatermarkten kunnen oplossingen voor de waterproblemen van het Westen promoten Hoe te verminderen Nitroacetophenone met Tin & HCL
Hoe te verminderen Nitroacetophenone met Tin & HCL  Zwitserse stem om goksites in het buitenland te blokkeren
Zwitserse stem om goksites in het buitenland te blokkeren Rapport:Facebook, FTC bespreekt boete van miljarden dollars
Rapport:Facebook, FTC bespreekt boete van miljarden dollars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

