
Wetenschap
Hoe kom je erachter wat atoom heeft met alleen de elektronen?
* isotopen: Atomen van hetzelfde element kunnen verschillende aantallen neutronen hebben. Dit betekent dat u atomen kunt hebben met hetzelfde aantal elektronen, maar verschillende atoommassa's. Carbon-12 en koolstof-14 hebben bijvoorbeeld beide 6 elektronen, maar ze hebben verschillende aantallen neutronen.
* ionen: Atomen kunnen elektronen verkrijgen of verliezen en ionen worden. Een neutraal natriumatoom (NA) heeft 11 elektronen, maar een natriumion (Na+) heeft slechts 10.
* Elektronenconfiguratie: Hoewel de elektronenconfiguratie (de opstelling van elektronen in energieniveaus) u aanwijzingen over het element kan geven, identificeert het het atoom niet uniek.
Wat u nodig hebt om het atoom te bepalen:
1. Aantal protonen: Het aantal protonen bepaalt het atoomnummer, dat een element op unieke wijze identificeert. U kunt het aantal protonen vinden uit het aantal elektronen in een neutraal atoom.
2. Massienummer: Het massacummer (protonen + neutronen) kan helpen onderscheid te maken tussen isotopen van hetzelfde element.
Voorbeeld:
Als u een atoom met 8 elektronen heeft, kunt u het volgende afleiden:
* Neutraal atoom: Het heeft 8 protonen (omdat het aantal protonen gelijk is aan het aantal elektronen in een neutraal atoom).
* element: Het is zuurstof (zuurstof heeft een atoomnummer van 8).
* isotoop: U zou het massanummer nodig hebben om de specifieke isotoop te identificeren (bijv. Oxygen-16 of zuurstof-18).
Samenvattend is het aantal elektronen alleen niet voldoende om een atoom te identificeren. U hebt aanvullende informatie nodig, zoals het aantal protonen (atoomnummer) en mogelijk het massacummer om het specifieke atoom te bepalen.
 Meer dan een half miljoen Amerikanen die worden blootgesteld aan giftige luchtvervuiling, lopen risico op kanker boven de EPA-richtlijnen
Meer dan een half miljoen Amerikanen die worden blootgesteld aan giftige luchtvervuiling, lopen risico op kanker boven de EPA-richtlijnen Vulkanische bogen worden gevormd door het diep smelten van gesteentemengsels
Vulkanische bogen worden gevormd door het diep smelten van gesteentemengsels Hoe zwavel hielp om de aarde bewoonbaar te maken vóór de opkomst van zuurstof
Hoe zwavel hielp om de aarde bewoonbaar te maken vóór de opkomst van zuurstof Een nieuwe methode zou de uitstoot van broeikasgassen in de landbouw aanzienlijk kunnen verminderen
Een nieuwe methode zou de uitstoot van broeikasgassen in de landbouw aanzienlijk kunnen verminderen  NASA vindt een klein gebied met sterke stormen in tropische storm Fabio
NASA vindt een klein gebied met sterke stormen in tropische storm Fabio
Hoofdlijnen
- Nieuw AI-systeem kan het gedrag van fruitvliegjes decoderen:waarom dat cruciaal is voor toekomstig onderzoek naar de menselijke genetica
- Studie beantwoordt een al lang bestaand mysterie over slangenpredatie
- Onderzoekers ontdekken door het meten van krachten hoe het darmepitheel vouwt en beweegt
- Welk dier heeft scherpe tanden en evolueer het eten van vlees?
- Wat zijn twee manieren waarop schimmels mensen kunnen helpen?
- Genetische aanpassingen hebben de bloedsamenstelling van twee populaties uit Papoea-Nieuw-Guinea beïnvloed, blijkt uit onderzoek
- DNA-barcodes:zijn ze altijd nauwkeurig?
- Voedselketen: definitie, soorten, belang en voorbeelden (met diagram)
- Waarom is een polypetide belangrijk?
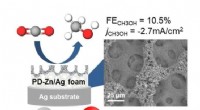
- Omzetting van kooldioxide naar methanol
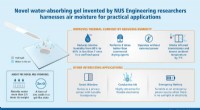
- Nieuwe hydrogel benut luchtvochtigheid voor praktische toepassingen
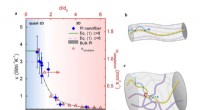
- Willekeurige wandeling van warmtedragers in amorfe polymeren
- Zouttolerante bacteriën met een honger naar slib maken biologisch afbreekbare kunststoffen
- Nieuwe eiwitstructuren om rationeel medicijnontwerp te ondersteunen
 Onderzoekers vinden een manier om AI-creativiteit te benutten
Onderzoekers vinden een manier om AI-creativiteit te benutten Tweedimensionale koolstofnetwerken:Graphdiyne als functioneel lithium-ion-opslagmateriaal
Tweedimensionale koolstofnetwerken:Graphdiyne als functioneel lithium-ion-opslagmateriaal Waarom Amerikanen het nooit eens zullen worden over olieboringen in het Arctic National Wildlife Refuge
Waarom Amerikanen het nooit eens zullen worden over olieboringen in het Arctic National Wildlife Refuge  Robotisch grijpmechanisme bootst na hoe zeeanemonen een prooi vangen
Robotisch grijpmechanisme bootst na hoe zeeanemonen een prooi vangen Onderzoekers ontdekken nieuw type geheugeneffect in overgangsmetaaloxiden
Onderzoekers ontdekken nieuw type geheugeneffect in overgangsmetaaloxiden Hoe beïnvloedt de axiale kanteling van Saturnus het seizoen?
Hoe beïnvloedt de axiale kanteling van Saturnus het seizoen?  Frequente extreme bosbranden zijn onze nieuwe realiteit:we moeten leren leven met met rook gevulde lucht
Frequente extreme bosbranden zijn onze nieuwe realiteit:we moeten leren leven met met rook gevulde lucht Welke algemene relativiteitstheorie?
Welke algemene relativiteitstheorie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

