
Wetenschap
Welk volume C2 H2 zou bij standaarddruk nodig zijn om 200 gram H2 te verkrijgen?
1. Bepaal de mol van H₂
* De molaire massa van H₂ is 2.016 g/mol.
* Verdeel de gegeven massa van H₂ door zijn molaire massa:
200 g H₂ / 2.016 g / mol =99,2 mol H₂
2. Gebruik de stoichiometrie van de reactie
* De evenwichtige chemische vergelijking voor de reactie is:
C₂h₂ → 2h₂
* Deze vergelijking vertelt ons dat 1 mol C₂h₂ 2 mol H₂ produceert.
3. Bereken de mol C₂h₂ nodig
* Omdat de verhouding 1:2 is, hebben we de helft van de mol C₂h₂ nodig in vergelijking met H₂.
* Mol c₂h₂ =99.2 mol H₂ / 2 =49,6 mol C₂h₂
4. Breng de ideale gaswet aan om het volume te vinden
* De ideale gaswet is:PV =nrt
* P =druk (standaarddruk is 1 atm)
* V =volume (wat we willen vinden)
* n =aantal mol (49,6 mol C₂h₂)
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (standaardtemperatuur is 273,15 K)
* Los op voor V:
V =(nrt) / p
V =(49,6 mol * 0,0821 l · atm / mol · k * 273.15 k) / 1 atm
V = 1110 l
Daarom zou ongeveer 1110 liter C₂h₂ bij standaarddruk nodig zijn om 200 gram H₂ te verkrijgen.
 Zijn tornado's gelinkt aan klimaatverandering? De wetenschap is nog niet definitief
Zijn tornado's gelinkt aan klimaatverandering? De wetenschap is nog niet definitief Nieuwe geologische kaart onthult geheimen van het ijskoude binnenland van Groenland
Nieuwe geologische kaart onthult geheimen van het ijskoude binnenland van Groenland  Vanuatu is van plan om het hele vulkanische eiland permanent te evacueren
Vanuatu is van plan om het hele vulkanische eiland permanent te evacueren Een cricket laten stilstaan
Een cricket laten stilstaan Wetenschappers schijnen licht op kleine kristallen achter onverwachte gewelddadige uitbarstingen
Wetenschappers schijnen licht op kleine kristallen achter onverwachte gewelddadige uitbarstingen
Hoofdlijnen
- Welke cellen kunnen door het menselijk oog worden gezien?
- Wat is een CDC in de biologie?
- Gebaseerd op genomische studies wanneer is er een verandering in gensequenties opgetreden die leiden tot de manier waarop hersenen spraak verwerkt?
- Techniek op de plaats delict die wordt gebruikt om schildpadden te volgen
- Heeft aminozuren invloed op eiwitfuncties?
- Hoe fotosynthese licht vangt en het leven op aarde aandrijft
- Coliforme bacteriën zijn het moeilijkst te onderscheiden van SS -ziekteverwekker?
- Een zeldzame en weinig bekende groep apen zou de tropische bossen in Afrika kunnen helpen redden
- Wat gorillapoep ons vertelt over evolutie en menselijke gezondheid
- Nieuwe biologische en veiligere zepen

- Gelatine kan binnenkort onze wearables en IoT-apparaten van stroom voorzien

- Nieuw onderzoek toont aan dat alle solid-state batterijen met de hoogste energiedichtheid nu mogelijk zijn
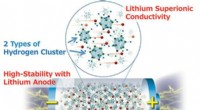
- Het bereiken van stabiele K-opslagprestaties van met koolstofbolletjes opgesloten antimoon via elektrolytregulatie
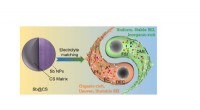
- Onderzoekers lossen 100 jaar oude metallurgiepuzzel op

 Lenovo brengt dit jaar een 23-inch tablet-pc uit?
Lenovo brengt dit jaar een 23-inch tablet-pc uit?  DY Centauri:Stellaire evolutie terwijl je kijkt
DY Centauri:Stellaire evolutie terwijl je kijkt Waarom we filosofie en ethiek van cyberoorlogvoering nodig hebben
Waarom we filosofie en ethiek van cyberoorlogvoering nodig hebben Na inschrijvingsdips, openbare scholen hopen op herstel van de herfst
Na inschrijvingsdips, openbare scholen hopen op herstel van de herfst Wat gebeurt er als kalium reageert met water en zuurstof?
Wat gebeurt er als kalium reageert met water en zuurstof?  In Parijs, auto's gedwongen om plaats te maken voor de tweewielige revolutie
In Parijs, auto's gedwongen om plaats te maken voor de tweewielige revolutie Wordt mitochondriën bekend als het Power House of Cellen?
Wordt mitochondriën bekend als het Power House of Cellen?  Hoeveel SCF in een MCF van aardgas?
Hoeveel SCF in een MCF van aardgas?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

