
Wetenschap
U maakt een nieuwe chemische stof, maar de reactiesnelheid is erg traag als u warmt waarschijnlijk zal zijn?
* Verhoogde kinetische energie: Het verwarmen van een reactiemengsel verhoogt de kinetische energie van de moleculen. Dit betekent dat ze sneller bewegen en vaker botsen.
* Meer effectieve botsingen: Met meer botsingen is er een grotere kans op succesvolle botsingen, waarbij moleculen correct zijn georiënteerd en voldoende energie hebben om bindingen te verbreken en nieuwe te vormen.
* Activeringsenergie: Elke reactie heeft een activeringsenergiebarrière die moleculen moeten overwinnen om te reageren. Warmte biedt de energie die nodig is om die barrière te bereiken.
Er zijn echter enkele belangrijke voorbehouden om in gedachten te houden:
* Ontleding: Verwarming kan de reactanten of producten soms ontleden, wat leidt tot ongewenste nevenreacties of een verandering in het gewenste resultaat.
* evenwicht: Voor omkeerbare reacties kan verwarming het evenwicht naar de endotherme richting verschuiven, waardoor de opbrengst van het gewenste product mogelijk wordt verminderd.
* katalyse: Soms kan het toevoegen van een katalysator effectiever zijn dan alleen het verhogen van de temperatuur. Katalysatoren versnellen de reacties door een alternatieve reactieroute te bieden met een lagere activeringsenergie.
Samenvattend: Het verwarmen van een reactie verhoogt in het algemeen de reactiesnelheid, maar het is belangrijk om de potentiële nadelen te overwegen en alternatieve methoden zoals katalyse te verkennen voordat ze alleen afhankelijk zijn van temperatuurstijgingen.
 Combinatie van knoflook en fluor is veelbelovend als medicamenteuze therapie
Combinatie van knoflook en fluor is veelbelovend als medicamenteuze therapie Wat is een van de factoren die wetenschappers denken dat bijdraagt aan de ozonlaag van de vernietiging?
Wat is een van de factoren die wetenschappers denken dat bijdraagt aan de ozonlaag van de vernietiging?  Wat is het verschil tussen atomaire massa en nummer?
Wat is het verschil tussen atomaire massa en nummer?  De temperatuur waarbij de dampdruk van een vloeistof een externe 1 atm heeft, is de?
De temperatuur waarbij de dampdruk van een vloeistof een externe 1 atm heeft, is de?  Wat is het type hybridisatie van koolstof in CH3CHCH2?
Wat is het type hybridisatie van koolstof in CH3CHCH2?
 Kenia verbiedt plastic tassen om vervuiling te bestrijden
Kenia verbiedt plastic tassen om vervuiling te bestrijden Welke landen bevinden zich in de poolzone?
Welke landen bevinden zich in de poolzone?  Supercycloon Amphan treft Bangladesh, India
Supercycloon Amphan treft Bangladesh, India Eet groen om het milieu te sparen, zegt IPCC:Hoe weet je of dat jou betekent?
Eet groen om het milieu te sparen, zegt IPCC:Hoe weet je of dat jou betekent? Onderzoek werpt licht op altruïsme:digitale evolutietechnieken laten zien hoe soorten altruïstisch worden
Onderzoek werpt licht op altruïsme:digitale evolutietechnieken laten zien hoe soorten altruïstisch worden
Hoofdlijnen
- Typen cellijnen
- Biologen maken toolkit voor het afstemmen van genetische circuits
- DNA-studies tonen micro-evolutie aan bij pinguïns
- Welke cellulaire structuur was zichtbaar gemeenschappelijk voor alle soorten spiercellen?
- Leg uit waarom stamcellen kunnen dupliceren terwijl de wang
- Gespecialiseerde eilandjescellen die hormonen afscheiden worden verspreid over de?
- De nanoscopische structuur die onze genen opsluit
- Kunnen ziektedetecterende honden de dikhoornschapen in South Dakota helpen redden?
- Waar betekent gespecialiseerde cellen?
- Katalysatoren voor een betere productie van biobrandstoffen

- Nieuw flexibel materiaal verandert zijn poreuze aard bij blootstelling aan licht
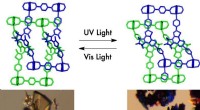
- Neutronen gebruiken om te bestuderen hoe resistente bacteriën evolueren

- Een algemeen chemisch principe voor het maken van sluitingsstabiliserende integrineremmers
- Nieuwe NMR-techniek biedt moleculair inzicht in levende organismen

 Wat zijn de 3 verschillende soorten symbiotische factoren?
Wat zijn de 3 verschillende soorten symbiotische factoren?  Nationaal onderwijsbeleid -- oh, wat is het veranderd
Nationaal onderwijsbeleid -- oh, wat is het veranderd  Een nieuw cellulair proces om materialen van nanoformaat te verzwelgen
Een nieuw cellulair proces om materialen van nanoformaat te verzwelgen Wat zijn ‘forever chemicaliën’ precies – en kunnen we verder gaan dan deze?
Wat zijn ‘forever chemicaliën’ precies – en kunnen we verder gaan dan deze?  Termietenheuvels uit de kathedraal inspireren het ontwerp van de maanstructuur
Termietenheuvels uit de kathedraal inspireren het ontwerp van de maanstructuur  Welk type reactie is HC2H3O2 (aq) plus NaHCO3 NaC2H3O2 H2CO3 (aq)?
Welk type reactie is HC2H3O2 (aq) plus NaHCO3 NaC2H3O2 H2CO3 (aq)?  Hoe PSI naar PSIG
Hoe PSI naar PSIG Uiterst schoon fabricageplatform produceert bijna ideale 2D-transistoren
Uiterst schoon fabricageplatform produceert bijna ideale 2D-transistoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

