
Wetenschap
Hoe wordt Hess Law gebruikt om de enthalpie -verandering van reactie te berekenen?
Hess's Law:een krachtig hulpmiddel voor enthalpieberekeningen
De wet van Hess is een fundamenteel principe in de thermochemie waarin staat: De enthalpieverandering van een reactie is onafhankelijk van het genomen pad , wat betekent dat het hetzelfde is, of de reactie in één stap of meerdere stappen optreedt. Deze wet stelt ons in staat om de enthalpiewijziging van een reactie te berekenen die niet direct kan worden gemeten door de enthalpiewijzigingen van bekende reacties te gebruiken.
Hier is hoe de wet van Hess wordt gebruikt:
1. Identificeer de doelreactie: Bepaal de gebalanceerde chemische vergelijking voor de reactie waarvan de enthalpieverandering u wilt berekenen.
2. Bekende reacties vinden: Zoek reacties met bekende enthalpiewijzigingen (meestal gegeven in tabellen of gegevensbladen) waarbij de reactanten en producten van de doelreactie betrokken zijn.
3. manipuleer de bekende reacties: Mogelijk moet u:
* reverse Een bekende reactie om de richting van de doelreactie te evenaren. Vergeet niet dat het omkeren van een reactie het teken van zijn enthalpiewijziging verandert.
* vermenigvuldigen Een bekende reactie met een factor die overeenkomt met de stoichiometrische coëfficiënten van de doelreactie. Vergeet niet dat het vermenigvuldigen van een reactie met een factor ook zijn enthalpieverandering vermenigvuldigt met die factor.
4. Combineer de gemanipuleerde reacties: Voeg de gemanipuleerde reacties bij elkaar toe. De enthalpieverandering van de gecombineerde reactie zal de som zijn van de enthalpieveranderingen van de individuele reacties.
5. Zorg voor annulering: Zorg ervoor dat alle soorten die aan beide zijden van de gecombineerde reacties verschijnen, annuleren, waardoor alleen de reactanten en producten van de doelreactie achterblijven.
6. Bereken de enthalpiewijziging: De enthalpieverandering van de doelreactie is de som van de enthalpieveranderingen van de gemanipuleerde reacties.
Voorbeeld:
Laten we de enthalpiewijziging van de volgende reactie berekenen:
`` `
CO (G) + 1/2 O2 (G) -> CO2 (G)
`` `
We kennen de volgende reacties en hun enthalpiewijzigingen:
`` `
C (s) + o2 (g) -> CO2 (g) ΔH =-393,5 kJ/mol
C (s) + 1/2 o2 (g) -> co (g) Δh =-110,5 kJ/mol
`` `
Om de doelreactie te krijgen, kunnen we:
* Keer de tweede reactie om:
`` `
Co (g) -> c (s) + 1/2 o2 (g) Δh =+110,5 kJ/mol
`` `
* Voeg de omgekeerde tweede reactie toe aan de eerste reactie:
`` `
C (s) + o2 (g) -> CO2 (g) ΔH =-393,5 kJ/mol
Co (g) -> c (s) + 1/2 o2 (g) Δh =+110,5 kJ/mol
-----------------------------
CO (G) + 1/2 O2 (G) -> CO2 (G) AH =-283 KJ/MOL
`` `
Daarom is de enthalpieverandering van de doelreactie -283 kJ/mol .
Sleutelpunten:
* De wet van Hess is een krachtig hulpmiddel voor het berekenen van enthalpie -veranderingen van reacties die moeilijk of onmogelijk te meten zijn.
* Het is gebaseerd op het principe dat enthalpie -veranderingen toestandsfuncties zijn, wat betekent dat ze alleen afhankelijk zijn van de initiële en uiteindelijke toestanden van het systeem, niet op het genomen pad.
* Manipuleer zorgvuldig bekende reacties om te passen bij de doelreactie en aandacht te schenken aan de tekenen en coëfficiënten van enthalpie -veranderingen.
Door de wet van Hess te gebruiken, kunt u enthalpie -veranderingen voorspellen voor een breed scala aan reacties met behulp van bekende thermochemische gegevens.
 Nieuwe baanbrekende zeolietkatalysatoren gesynthetiseerd
Nieuwe baanbrekende zeolietkatalysatoren gesynthetiseerd Onconventionele technologie verbetert composieten die belangrijk zijn voor de automobiel-, ruimtevaart- en hernieuwbare energie-industrie
Onconventionele technologie verbetert composieten die belangrijk zijn voor de automobiel-, ruimtevaart- en hernieuwbare energie-industrie  Biobased hars:een doorbraak in rapid prototyping
Biobased hars:een doorbraak in rapid prototyping Welk bioom heeft de laagste temperatuur?
Welk bioom heeft de laagste temperatuur?  Hoe elektronen springen van de ene schaal naar de andere in aanwezigheid van verboden zone een atoom?
Hoe elektronen springen van de ene schaal naar de andere in aanwezigheid van verboden zone een atoom?
 Een succesvolle COP26 is essentieel voor de toekomst van de aarde. Dit is wat er goed moet gaan
Een succesvolle COP26 is essentieel voor de toekomst van de aarde. Dit is wat er goed moet gaan  Bij het voorspellen van ondiepe maar gevaarlijke aardverschuivingen, grootte doet er toe
Bij het voorspellen van ondiepe maar gevaarlijke aardverschuivingen, grootte doet er toe Sulfieten en bisulfieten in ondiepe meren hebben mogelijk de weg geëffend voor de eerste biologische moleculen van de aarde
Sulfieten en bisulfieten in ondiepe meren hebben mogelijk de weg geëffend voor de eerste biologische moleculen van de aarde 30 behandeld voor blootstelling aan gas terwijl de vulkaan in Indonesië uitbarst
30 behandeld voor blootstelling aan gas terwijl de vulkaan in Indonesië uitbarst De rol van algen in de landbouw
De rol van algen in de landbouw
Hoofdlijnen
- Kikkers onthullen mechanisme dat de levensvatbaarheid van hybriden bepaalt
- De functie van macromoleculen
- Isoleert het het axon van neuron?
- Nieuwe studie biedt aanwijzingen over hoe kanker zich naar de hersenen verspreidt
- Zijn protozoanen warm bloedig of koelbloedig?
- Wat zijn grafologische kenmerken?
- Vliegen onder de radar:multiresistente bacteriën verschuilen zich tussen darmbacteriën van asymptomatische menselijke dragers
- Wat zijn de 6 componenten van gezondheid en hun betekenis?
- Wetenschappers tonen aan dat ribosomen een onverwachte rol spelen bij de vorming van bloedvaten
- Nieuwe methode stimuleert de vorming van syngas uit biopolyolen
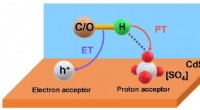
- Nieuwe katalysatoren verbeteren de efficiëntie van de ureumsynthese bij omgevingsomstandigheden
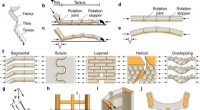
- Nieuwe ontdekking in exoskeletten van dieren leidt tot vooruitgang in het ontwerpen van bouwmaterialen
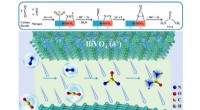
- Studie suggereert route naar verbetering oplaadbare lithiumbatterijen

- Kunststofmarkten passen zich aan in het tijdperk van COVID-19

 Math-problemen oplossen met behulp van een stroomdiagram
Math-problemen oplossen met behulp van een stroomdiagram Snelheidsovertreders blijven de wet overtreden, zelfs na boetes en crashes
Snelheidsovertreders blijven de wet overtreden, zelfs na boetes en crashes Welke temperatuur is verzadiging bereikt?
Welke temperatuur is verzadiging bereikt?  De belofte van nanofabricage met behulp van DNA-origami
De belofte van nanofabricage met behulp van DNA-origami Hoe maak je een Streak-test met Rocks
Hoe maak je een Streak-test met Rocks Wordt aluminiumhydroxide gebruikt in fotografie?
Wordt aluminiumhydroxide gebruikt in fotografie?  Hoeveel soorten lassen zijn er?
Hoeveel soorten lassen zijn er?  Een binding tussen twee atomen met een verschil in elektronegativiteiten groter dan 1,7 wordt geclassificeerd als?
Een binding tussen twee atomen met een verschil in elektronegativiteiten groter dan 1,7 wordt geclassificeerd als?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

