
Wetenschap
Hoe elektronen springen van de ene schaal naar de andere in aanwezigheid van verboden zone een atoom?
elektronen en energieniveaus
* Atomische schalen: Elektronen in een atoom bezetten specifieke energieniveaus die "schelpen" worden genoemd. Deze schelpen zijn als "vloeren" in een gebouw, waarbij elke schaal een ander energieniveau vertegenwoordigt. Hoe dichter de schaal bij de kern ligt, hoe lager de energie.
* Elektronenexcitatie: Wanneer een elektron energie krijgt (bijvoorbeeld door een foton van licht te absorberen), kan het "springen" naar een hoger energieniveau. Dit wordt excitatie genoemd.
* Elektronenontspanning: Een opgewonden elektron is onstabiel en wil terugkeren naar zijn lagere energietoestand. Als dat zo is, geeft het de overtollige energie vrij, vaak als een foton van licht. Dit is de reden waarom atomen specifieke golflengten van licht uitzenden.
De verboden zone (band gap)
* Energiebanden: In vaste stoffen zijn de energieniveaus van elektronen niet langer discrete, maar vormen banden van dicht bij elkaar geplaatste energieniveaus. Deze banden worden gescheiden door openingen genaamd verboden zones of band gaten .
* dirigenten, isolatoren, halfgeleiders: De grootte van de bandafstand bepaalt de elektrische geleidbaarheid van het materiaal.
* dirigenten: Hebben zeer kleine bandhiaten, waardoor elektronen gemakkelijk tussen banden kunnen bewegen.
* isolatoren: HEBBEN GROTE BAND -openingen hebben, die aanzienlijke energie nodig hebben om elektronen over de gap te opwinden.
* halfgeleiders: Hebben bandlocaties van tussenliggende grootte, waardoor enige geleidbaarheid onder bepaalde omstandigheden mogelijk is.
Hoe elektronen "springen" in aanwezigheid van een verboden zone
1. excitatie: Om een elektron van een lagere energieband naar een hogere te laten springen, moet het voldoende energie verwerven om de bandafstand te overwinnen. Deze energie kan voortkomen uit:
* warmte: Thermische energie kan elektronen opwinden.
* licht: Fotonen van licht met voldoende energie kunnen elektronen opwinden.
* elektrische velden: Sterke elektrische velden kunnen de nodige energie bieden.
2. Springend over: Zodra het elektron voldoende energie krijgt, kan het over de verboden zone springen en een lege energietoestand in de hogere band bezetten.
3. Ontspanning: Een elektron in een hogere energieband is onstabiel en wil terugkeren naar een lager energieniveau. Het kan dit doen door:
* emissie: Een foton van licht vrijgeven (lichtemissie).
* botsingen: Energie verliezen door botsingen met andere atomen of elektronen.
belangrijke punten
* kwantummechanica: Het gedrag van elektronen in atomen wordt bepaald door kwantummechanica, die de golfachtige aard van deeltjes beschrijft.
* Discrete energieniveaus: Elektronen kunnen alleen specifieke energieniveaus bezetten, geen waarde daartussenin. Dit verklaart waarom elektronen springen in plaats van soepel overgang tussen energieniveaus.
Laat het me weten als je meer informatie wilt over een van deze concepten!
 Wat zijn de bijwerkingen van 20meq eetlepel kalium CHL?
Wat zijn de bijwerkingen van 20meq eetlepel kalium CHL?  Structuur-eigenschap relaties in nanoporeuze en amorfe iridiumoxiden
Structuur-eigenschap relaties in nanoporeuze en amorfe iridiumoxiden Wat voor soort stof is een goede warmtegeleider?
Wat voor soort stof is een goede warmtegeleider?  Het nabootsen van het falen om de sterkte in composieten te vinden
Het nabootsen van het falen om de sterkte in composieten te vinden Enzymen en bacteriën bewegen richting, maar bacteriën naar voedsel, enzymen weg
Enzymen en bacteriën bewegen richting, maar bacteriën naar voedsel, enzymen weg
 Waarom Canada zijn netto-nul-belofte om de CO2-uitstoot te verminderen moet laten vallen?
Waarom Canada zijn netto-nul-belofte om de CO2-uitstoot te verminderen moet laten vallen? De klodder abnormale omstandigheden verhoogde de ozonniveaus in de westerse VS
De klodder abnormale omstandigheden verhoogde de ozonniveaus in de westerse VS Tropische storm Michael opgewaardeerd tot orkaan in Golf van Mexico
Tropische storm Michael opgewaardeerd tot orkaan in Golf van Mexico Wat is een voetpad? Een pad waarop mensen kunnen lopen?
Wat is een voetpad? Een pad waarop mensen kunnen lopen?  NASA vindt tropische cyclonen Vayu uitgerekt
NASA vindt tropische cyclonen Vayu uitgerekt
Hoofdlijnen
- Welke cel begint meiose en mitose?
- Begrijpen waarom BRCA2 verband houdt met het risico op kanker
- Een mitose-mysterie opgelost:hoe chromosomen perfect uitgelijnd zijn in een delende cel
- Studenten zeggen dat ze een milieuvriendelijke manier hebben gevonden om Japanse kevers te vangen en te doden
- Welk enzym voegt nucleïnezuren toe aan de DNA-keten?
- Onderzoekers passen gist aan om te laten zien hoe planten reageren op een belangrijk hormoon
- Kan een kleine invasieve slak Latijns-Amerikaanse koffie helpen redden?
- Wanneer een cel zich voorbereidt om zich te verdelen om zijn dochter alle informatie te hebben die hij moet overzien?
- Welke mRNA-codons zullen het translatieproces starten?
- Team ontdekt dat biologische nanofibrillen op efficiënte wijze waardevolle metaalelementen uit water kunnen halen
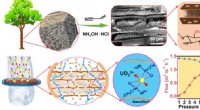
- Functionaliseren van niet-geactiveerde alkanen met behulp van reacties op basis van katalysatoren gemaakt van meer overvloedige materialen
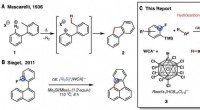
- Xenon verbetert de eigenschappen van maxillofaciale en orthopedische implantaten

- Neutronen maken structurele veranderingen in moleculaire borstels zichtbaar

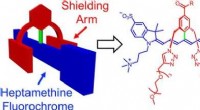
- Stabiele en functionele kleurstoffen voor nabij-infrarood fluorescentiebeeldvorming van levende onderwerpen
 Hoeveel hoeveelheid opgeloste zuurstof is er aanwezig in zuiver water?
Hoeveel hoeveelheid opgeloste zuurstof is er aanwezig in zuiver water?  Nanogestructureerde tingassensoren kunnen de wereld helpen de klimaatcrisis aan te pakken
Nanogestructureerde tingassensoren kunnen de wereld helpen de klimaatcrisis aan te pakken De energie die wordt gebruikt in de Calvin -cyclusproductie van koolhydraten komt vandaan?
De energie die wordt gebruikt in de Calvin -cyclusproductie van koolhydraten komt vandaan?  Waterdruppels vormen grafeen nanostructuren
Waterdruppels vormen grafeen nanostructuren Analyse van oude tanden onthult aanwijzingen over hoe sociaal-politieke systemen groeien
Analyse van oude tanden onthult aanwijzingen over hoe sociaal-politieke systemen groeien Science Fair Projecten over planten: groeien ze sneller met frisdrank, water of gatorade?
Science Fair Projecten over planten: groeien ze sneller met frisdrank, water of gatorade?  Naar efficiëntere zonnecellen
Naar efficiëntere zonnecellen Nieuwe lasertechniek maakt krachtigere - en kleinere - deeltjesversnellers mogelijk
Nieuwe lasertechniek maakt krachtigere - en kleinere - deeltjesversnellers mogelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

