
Wetenschap
Waarom zijn alle atoomnummers heel en het meeste massacummer eindigen met een decimalen?
Atomisch nummer:
* vertegenwoordigt protonen: Het atoomnummer definieert een element en is gelijk aan het aantal protonen in zijn kern.
* protonen zijn fundamentele deeltjes: Protonen zijn discreet, wat betekent dat ze bestaan als hele eenheden. Je kunt geen halve proton hebben.
* elementen worden gedefinieerd door protonen: Elk element heeft een uniek aantal protonen. Het aantal protonen wijzigen verandert het element volledig.
Atomische massa:
* vertegenwoordigt een gemiddeld gewicht: De atomaire massa is de gemiddelde massa van alle isotopen van een element.
* isotopen hebben verschillende neutronen: Isotopen van hetzelfde element hebben hetzelfde aantal protonen, maar verschillende aantallen neutronen.
* neutronen dragen bij aan massa: Neutronen hebben, zoals protonen, massa.
* Gemiddelde weging: De atomaire massa die je op het periodiek systeem ziet, is een gewogen gemiddelde van de massa's van alle isotopen van dat element, rekening houdend met hun relatieve overvloed in de natuur. Dit gemiddelde proces resulteert vaak in een decimaal aantal.
Voorbeeld:
Overweeg chloor (CL).
* Atomisch nummer: 17 (wat betekent dat het 17 protonen heeft)
* isotopen: Chloor heeft twee hoofdisotopen:chloor-35 (17 protonen en 18 neutronen) en chloor-37 (17 protonen en 20 neutronen).
* Atomische massa: De atoommassa van chloor is ongeveer 35,45. Dit komt omdat chloor-35 overvloediger is dan chloor-37, dus de massa draagt meer bij aan het algehele gemiddelde.
Key Takeaway: Atomische getallen zijn hele getallen omdat ze het aantal protonen vertegenwoordigen, die fundamentele deeltjes zijn. Atomische massa's zijn vaak decimalen omdat ze het gewogen gemiddelde van de massa's van alle isotopen van een element vertegenwoordigen, rekening houdend met hun verschillende neutronenaantallen en overvloed.
 Wat is het oxidatiegetal van antimoon in Sb2O5?
Wat is het oxidatiegetal van antimoon in Sb2O5?  Wat is het wetenschappelijke proces dat ervoor zorgt dat het waterpeil daalt als het warmer wordt?
Wat is het wetenschappelijke proces dat ervoor zorgt dat het waterpeil daalt als het warmer wordt?  Met behulp van licht, rode bloedcellen en een honingbijpeptide om therapeutische eiwitten te leveren
Met behulp van licht, rode bloedcellen en een honingbijpeptide om therapeutische eiwitten te leveren Deeltjes in een gas verspreiden zich?
Deeltjes in een gas verspreiden zich?  Waar komt het vervuilende zwaveldioxide vandaan?
Waar komt het vervuilende zwaveldioxide vandaan?
Hoofdlijnen
- Wat is het deel van een cel die fotosynthetes?
- Hoe noem je chromosoom dat op elkaar lijkt en genen draagt voor dezelfde eigenschap?
- Een celbioloog behandelt een zodat zuurstof niet kan diffunderen over het membraan welke organel hierdoor rechtstreeks zal worden beïnvloed?
- Wie patenteert wiens genoom?
- Onderzoekers onthullen een nieuw mechanisme van hyaluronzuur met een specifiek molecuulgewicht om de ontsteking van de gastheer te verbeteren
- Je bent wat je eet is net zo belangrijk voor vissen als voor mensen
- Welke 3 elementen worden gevonden in alle biologische macromoleculen?
- Welk waterorganisme heeft de hoogste concentratie PCB's?
- Kunnen veel populaties in een ecosysteem dezelfde niche delen?
- Een nieuwe methode voor de productie van geprotoneerde waterstof

- Polymeerfilm beschermt tegen elektromagnetische straling, signaal interferentie

- Nanocontainers voor gerichte medicijnafgifte

- Nieuwe coating brengt lithium-metaalbatterij dichter bij de realiteit

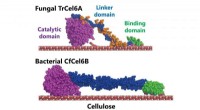
- Bacterieel cellulose-afbraaksysteem kan de productie van biobrandstoffen stimuleren
 Hoe gasturbinemotoren werken
Hoe gasturbinemotoren werken  Wormen leren hoe ze het foerageren kunnen optimaliseren door de sociale signalen van hun reactie te veranderen
Wormen leren hoe ze het foerageren kunnen optimaliseren door de sociale signalen van hun reactie te veranderen  Onderzoekers bestuderen actieve galactische kern tijdens de uitbarstingsfase
Onderzoekers bestuderen actieve galactische kern tijdens de uitbarstingsfase Wanneer zet je je klokken vooruit in 2010?
Wanneer zet je je klokken vooruit in 2010?  Nieuw artikel onthult hoe lessen die zijn geleerd tijdens COVID-19 ons kunnen voorbereiden op een nucleaire aanval
Nieuw artikel onthult hoe lessen die zijn geleerd tijdens COVID-19 ons kunnen voorbereiden op een nucleaire aanval Het catastrofale weer in Brazilië leidt tot een golf van complottheorieën
Het catastrofale weer in Brazilië leidt tot een golf van complottheorieën  Deutsche Telekom vol vertrouwen na winststijging Q1
Deutsche Telekom vol vertrouwen na winststijging Q1 Hoe wordt de toestand van de atmosfeer op een bepaalde tijd en plaats genoemd?
Hoe wordt de toestand van de atmosfeer op een bepaalde tijd en plaats genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

