
Wetenschap
Wat is S2-ion?
Hier is een uitsplitsing:
* s: Dit vertegenwoordigt het chemische symbool voor de element zwavel.
* 2-: Dit geeft aan dat het zwavelatoom twee elektronen heeft opgedaan.
Vorming:
Een neutraal zwavelatoom heeft 16 elektronen. Om een stabiel octet (8 elektronen) in zijn buitenste schaal te bereiken, krijgt het twee elektronen en wordt het een negatief geladen ion met 18 elektronen.
eigenschappen:
* opladen: -2
* Elektronenconfiguratie: [Ne] 3S
2
3p
6
* ionische straal: Groter dan het neutrale zwavelatoom.
* Reactiviteit: Sulfide -ionen zijn zeer reactief en vormen gemakkelijk verbindingen met vele andere elementen.
Voorbeelden:
* waterstofsulfide (H 2 S): Een kleurloos, vies ruikende gas geproduceerd door het verval van organisch materiaal.
* ijzersulfide (FES): Een zwarte vaste stof gevonden in sommige mineralen.
* Natriumsulfide (Na 2 S): Een kleurloze, in water oplosbare vaste stof die wordt gebruikt in verschillende industriële processen.
Opmerking:
Het sulfide-ion (S
2-
) is vaak betrokken bij de vorming van metalen sulfiden, die vaak in de natuur als mineralen worden aangetroffen.
 Zal het smogige L.A. in 2025 geen slechte lucht meer hebben? Houd je adem niet in
Zal het smogige L.A. in 2025 geen slechte lucht meer hebben? Houd je adem niet in Geologen identificeren diepgewortelde structuren die verborgen metalen lodes kunnen signaleren
Geologen identificeren diepgewortelde structuren die verborgen metalen lodes kunnen signaleren Geüpgraded waterrisicofilter kan de reactie van bedrijven op waterrisico's helpen transformeren
Geüpgraded waterrisicofilter kan de reactie van bedrijven op waterrisico's helpen transformeren Deense econoom gekozen tot nieuwe VN-milieuchef
Deense econoom gekozen tot nieuwe VN-milieuchef Veiligheidsraad:Zeelieden hebben betere voorspellingen voor tropische stormen nodig
Veiligheidsraad:Zeelieden hebben betere voorspellingen voor tropische stormen nodig
Hoofdlijnen
- Wat zijn de namen van organen in planten?
- Een eiwit-RNA-structuur geeft aan hoe virussen menselijke eiwitten opeisen
- Waarom transporteurs echt belangrijk zijn voor celfabrieken
- Hoe verschillen schimmels van een ander koninkrijk?
- Hoe het bewustzijn bij dieren onderzocht zou kunnen worden
- Technologie verhoogt melkgift met 9 procent
- Wat is de oorsprong van het leven op aarde?
- Hoe zijn de reproductieve organen of een mannelijk en vrouwelijk hetzelfde hoe ze verschillen?
- Bij mensen is het aantal tetrads gevormd tijdens mitose?
- Ingenieurs melden een nieuwe methode voor het produceren van nieuwe flexibele LCD-schermen

- Stazakken van hernieuwbare grondstoffen en nanocellulose

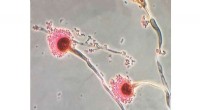
- Chemici kenmerken de dodelijke schimmel onder ons
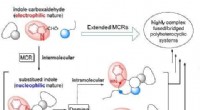
- Nieuwe multicomponent reactiegrenzen
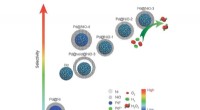
- Interfacial engineering core@shell nanodeeltjes voor actieve en selectieve directe H2O2-generatie
 US West worstelt om doelen te bereiken door vuur met vuur te bestrijden
US West worstelt om doelen te bereiken door vuur met vuur te bestrijden Herstel van de Braziliaanse Spixs-ara, gepopulariseerd in geanimeerde Rio-films, bedreigd door klimaatverandering
Herstel van de Braziliaanse Spixs-ara, gepopulariseerd in geanimeerde Rio-films, bedreigd door klimaatverandering  Virtual reality maakt plons, maar niet klaar voor prime time
Virtual reality maakt plons, maar niet klaar voor prime time Wat zijn drie soorten bewijsmateriaal dat de Wegeners-theorie Pangea en continentale drift ondersteunt?
Wat zijn drie soorten bewijsmateriaal dat de Wegeners-theorie Pangea en continentale drift ondersteunt?  Wat zijn de denkbeeldige lijnen die voor de evenaar staan?
Wat zijn de denkbeeldige lijnen die voor de evenaar staan?  Hoe verschillende soorten licht beïnvloeden de groei van de planten?
Hoe verschillende soorten licht beïnvloeden de groei van de planten?  ONS, Mexico breidt pact uit over beheer van overbelaste Colorado-rivier
ONS, Mexico breidt pact uit over beheer van overbelaste Colorado-rivier Wetenschappers tonen aan dat 'brekende golven' het magnetische veld van de aarde verstoren
Wetenschappers tonen aan dat 'brekende golven' het magnetische veld van de aarde verstoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

