
Wetenschap
Wat is de langste golflengte van licht die een zuurstofbinding in waterstofperoxide kan veroorzaken met 210 kJ per mol?
1. Converteer energie naar joules per molecuul
* We krijgen 210 kJ/mol.
* Avogadro's nummer (6.022 x 10²³ Moleculen/mol) is de conversiefactor voor moleculen naar mol.
* Bereken energie per molecuul:
(210 kJ/mol) * (1000 j/kJ)/(6.022 x 10²³ Moleculen/mol) =3,49 x 10⁻¹⁹ J/molecuul
2. Gebruik de Planck-Einstein-relatie
* De Planck-Einstein-relatie verbindt energie (e) en frequentie (ν) van licht:e =hν, waarbij h de constante van Planck is (6.626 x 10⁻³⁴ j⋅s).
* Herschikken om op te lossen voor frequentie:ν =e/h
* Bereken de frequentie:ν =(3,49 x 10⁻¹⁹ j) / (6.626 x 10⁻³⁴ j⋅s) =5,27 x 10¹⁴ Hz
3. Wavellengte berekenen
* De relatie tussen frequentie (ν) en golflengte (λ) wordt gegeven door de vergelijking:C =νλ, waarbij C de snelheid van het licht (3,00 x 10⁸ m/s) is.
* Herschikken om op te lossen voor golflengte:λ =c/ν
* Bereken golflengte:λ =(3,00 x 10⁸ m / s) / (5,27 x 10¹⁴ Hz) =5,69 x 10⁻⁷ m m
4. Converteren naar nanometers
* 1 meter (m) =10⁹ nanometers (nm)
* Converteer golflengte naar nanometers:5,69 x 10⁻⁷ m * (10⁹ nm/m) =569 nm
Antwoord: De langste golflengte van licht die een zuurstofbinding in waterstofperoxide kan breken met behulp van 210 kJ per mol is ongeveer 569 nm . Dit komt overeen met de Green gebied van het zichtbare lichtspectrum.
Hoofdlijnen
- Nieuw onderzoek werpt licht op hoe Salmonella zich in het lichaam verspreidt
- Bestrijding van het witte-neussyndroom bij vleermuizen
- Hoe beïnvloedt de cel het weefsel?
- Terugtrekkend ijs zorgt ervoor dat Canadese ijsberen een steeds groter risico lopen
- Wie was de uitvinder van genetische code?
- Als een dier uit de voedselketen wordt verdwenen, wat is dan het effect op de keten?
- Zijn alle microben strikt pathogeen?
- Onderzoekers tonen aan dat grotere plantengemeenschappen productiever zijn en gevoeliger voor klimaatopwarming
- Waarom wordt evolutie als theorie overgebracht?
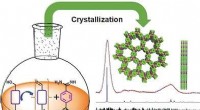
- Superieure fotokatalysatoren - covalent, kristallijne triazine-frameworks
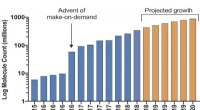
- Mega docking-bibliotheek klaar om de ontdekking van medicijnen te versnellen
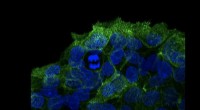
- Ontdekking van een nieuwe bron van 's werelds dodelijkste toxine
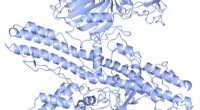
- Ontdekking binnen het celcyclusproces om inzicht te krijgen in cellulaire ziekten
- Ontkoppeling van elektronisch en thermisch transport

 Gemeenschappen met lage inkomens voorbereiden op orkanen begint met outreach
Gemeenschappen met lage inkomens voorbereiden op orkanen begint met outreach Een sprenkel van platina-nanodeeltjes op grafeen maakt hersensondes gevoeliger
Een sprenkel van platina-nanodeeltjes op grafeen maakt hersensondes gevoeliger Muonen draaien verhalen over onontdekte deeltjes
Muonen draaien verhalen over onontdekte deeltjes Hoeveel pond is 8,9 kilo?
Hoeveel pond is 8,9 kilo?  Wat kan het 14e-eeuwse Venetië ons leren over Ebola en andere opkomende bedreigingen?
Wat kan het 14e-eeuwse Venetië ons leren over Ebola en andere opkomende bedreigingen?  Warme Antarctische grotten herbergen geheim leven:wetenschappers
Warme Antarctische grotten herbergen geheim leven:wetenschappers Ananasboeren in Ghana hebben intensievere training nodig
Ananasboeren in Ghana hebben intensievere training nodig Datacenters in China gaan meer stroom verbruiken dan Australië:rapport
Datacenters in China gaan meer stroom verbruiken dan Australië:rapport
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


