
Wetenschap
Welk periodiek systeem is het meest reactief?
Dit is waarom:
* Eén valentie -elektron: Alkali -metalen hebben slechts één elektron in hun buitenste energieniveau (valentieschaal). Dit maakt ze zeer reactief omdat ze dit enkele elektron gemakkelijk verliezen om een stabiele edelgasconfiguratie te bereiken.
* Lage ionisatie -energie: Ze hebben lage ionisatie -energieën, wat betekent dat er relatief weinig energie voor nodig is om dat enkele valentie -elektron te verwijderen. Hierdoor reageren ze graag.
* Sterke reductiemiddelen: Vanwege hun neiging om elektronen te verliezen, zijn alkali -metalen krachtige reducerende middelen. Ze doneren gemakkelijk elektronen aan andere elementen of verbindingen.
Voorbeelden:
* lithium (li) Reageert heftig met water en produceert waterstofgas en lithiumhydroxide.
* natrium (na) reageert met water, het genereren van warmte en het vrijgeven van waterstofgas, wat explosief kan zijn.
* kalium (k) reageert explosief met water, zelfs in kleine hoeveelheden.
Belangrijke opmerking: Alkali -metalen zijn extreem reactief en moeten met extreme voorzichtigheid worden afgehandeld.
 Is schone lucht een pure stof of mengsel?
Is schone lucht een pure stof of mengsel?  Waarom is cyclohexaan een niet-polair molecuul. Het verschil in elektronegativiteit tussen koolstof en waterstof is punt 5, dus waarom is het niet-polair?
Waarom is cyclohexaan een niet-polair molecuul. Het verschil in elektronegativiteit tussen koolstof en waterstof is punt 5, dus waarom is het niet-polair?  Het bestuderen van de nasleep van gereflecteerde schokgolven onthult de cascade van chemische reacties die betrokken zijn bij verbranding
Het bestuderen van de nasleep van gereflecteerde schokgolven onthult de cascade van chemische reacties die betrokken zijn bij verbranding Wat is het resultaat van hydrolyse van een dipeptide?
Wat is het resultaat van hydrolyse van een dipeptide?  Wat is het elektronendomein van CH2O?
Wat is het elektronendomein van CH2O?
 Is de Dode Zee echt dood?
Is de Dode Zee echt dood?  Onderzoekers ontdekken hogere milieu-impact door uitstoot van kookfornuis
Onderzoekers ontdekken hogere milieu-impact door uitstoot van kookfornuis Volgens onderzoek heeft het Aralmeer Centraal-Azië aanzienlijk stoffiger gemaakt
Volgens onderzoek heeft het Aralmeer Centraal-Azië aanzienlijk stoffiger gemaakt  Nieuw onderzoek snijdt door de waas rond rookvrije tabaksproducten
Nieuw onderzoek snijdt door de waas rond rookvrije tabaksproducten Wetenschappers detecteren massale dood van zeeleven voor de kust van Kamtsjatka
Wetenschappers detecteren massale dood van zeeleven voor de kust van Kamtsjatka
Hoofdlijnen
- Gaan we de zesde grote uitsterving op aarde in?
- Wat is superregnum eukaryota?
- Waarom is een controlegroep nodig bij wetenschappelijke investering?
- Welk lichaamsdeel heeft buitenste en binnenste delen?
- Hoe kunnen de vier niveaus van organisatie in levende wezens meercellige organismen in staat stellen werklevenprocessen te verdelen?
- Enzymen die biobrandstoffen waard zijn, blijkt uit recent onderzoek
- Welke chemicaliën doden gist?
- Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
- Stappen van DNA Transcriptie
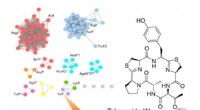
- Genoommining leidt tot een nieuw type peptide-prenylatie
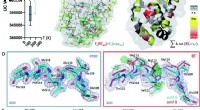
- Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
- Nieuw instrument om terrorisme te bestrijden

- Techniek om fosfor uit urine terug te winnen

- Nieuwe doorbraak in de strijd tegen antibioticaresistentie
 Invloed van aerodynamica op snelheid van een auto?
Invloed van aerodynamica op snelheid van een auto?  Hoe luchtvrachtvervoer werkt
Hoe luchtvrachtvervoer werkt  Braziliaanse rechtbank handhaaft grotendeels wet dat sommige angst Amazon pijn doet
Braziliaanse rechtbank handhaaft grotendeels wet dat sommige angst Amazon pijn doet Ontdekking werpt nieuw licht op hoe cellen bewegen
Ontdekking werpt nieuw licht op hoe cellen bewegen Waar wordt geleiding voor gebruikt?
Waar wordt geleiding voor gebruikt?  Wat is de gemiddelde hoeveelheid energiebeweging elk deeltje in een stof?
Wat is de gemiddelde hoeveelheid energiebeweging elk deeltje in een stof?  Biologisch afbreekbare verpakking ontwikkeld voor biologische schoonheidsmarkt
Biologisch afbreekbare verpakking ontwikkeld voor biologische schoonheidsmarkt Perseverance rover legt de geluiden vast van rijden op Mars
Perseverance rover legt de geluiden vast van rijden op Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

