
Wetenschap
Wat is het verschil tussen een zuur en een basis iets dat neutraal is?
zuren:
* Definitie: Stoffen die waterstofionen doneren (H+) wanneer opgelost in water.
* kenmerken:
* Smaakt zuur
* Reageer met metalen om waterstofgas te produceren
* Draai blauw lakmoespapier rood
* Heb een pH minder dan 7
* Voorbeelden:
* Zoutzuur (HCl)
* Zwavelzuur (h₂so₄)
* Citroenzuur (gevonden in citrusvruchten)
* Azijnzuur (gevonden in azijn)
Bases:
* Definitie: Stoffen die waterstofionen (H+) accepteren of hydroxide-ionen (OH-) doneren wanneer ze in water worden opgelost.
* kenmerken:
* Proef bitter
* Voel je glad
* Draai rood lakmoespapier blauw
* Hebben een pH groter dan 7
* Voorbeelden:
* Natriumhydroxide (NaOH)
* Kaliumhydroxide (KOH)
* Ammoniak (NH₃)
* Magnesiumhydroxide (Mg (OH) ₂)
Neutrale stoffen:
* Definitie: Stoffen die noch zuur noch basis zijn. Ze hebben een evenwichtige concentratie waterstof- en hydroxide -ionen.
* kenmerken:
* Proef niet zuur of bitter
* Reageren niet sterk met zuren of basen
* Heb een pH van 7
* Voorbeelden:
* Puur water (h₂o)
* Tafelzout (NaCl)
* Suiker (C₁₂h₂₂o₁₁)
De pH -schaal:
De pH -schaal is een numerieke manier om de zuurgraad of basiciteit van een oplossing te meten.
* 0 tot 6.9: Zuur
* 7: Neutrale
* 7.1 tot 14: Fundamenteel
Hoe zuren en basen reageren:
Zuren en basen neutraliseren elkaar in een chemische reactie genaamd neutralisatie . Deze reactie produceert zout en water.
Voorbeeld:
* HCl (zuur) + NaOH (base) → NaCl (zout) + H₂o (water)
Sleutelpunten:
* pH is een logaritmische schaal: Elke gehele getalverandering in pH vertegenwoordigt een tienvoudige verandering in zuurgraad of basiciteit.
* zuren en basen zijn essentieel voor veel biologische en industriële processen.
* Het concept van zuurgraad en basiciteit is belangrijk voor het begrijpen van chemische reacties en milieuproblemen.
 Hoe kunt u een cilinder met zuurstof verzenden?
Hoe kunt u een cilinder met zuurstof verzenden?  Moleculaire modelleringskit ter grootte van een micrometer toont echte chemische reacties
Moleculaire modelleringskit ter grootte van een micrometer toont echte chemische reacties Hoe maak je een 1% Sucrose-oplossing
Hoe maak je een 1% Sucrose-oplossing  CH2O gebruiken als de algemene formule voor een koolhydraat Wat is de algemene vergelijking fotosynthese?
CH2O gebruiken als de algemene formule voor een koolhydraat Wat is de algemene vergelijking fotosynthese?  Hoge veiligheid, flexibele en schaalbare oplaadbare planaire microbatterijen
Hoge veiligheid, flexibele en schaalbare oplaadbare planaire microbatterijen
Hoofdlijnen
- Wat ontstond er als eerste:een behendige hand of een behendige voet?
- Hoe biologische landbouw werkt
- Wat zijn de vijf accessoire organen van het gastro -intestinale systeem?
- Hoe hashtags en @-symbolen de taal op Twitter beïnvloeden
- Het grootste dinosaurusskelet van Europa is mogelijk gevonden in Portugal
- Hersenonderzoek:Zingende muizen vertonen tekenen van leren
- Onderzoeken waarom mannetjes groter zijn dan vrouwtjes onder zoogdieren
- Nieuwe studie onderzoekt ATP-synthase in zure toestand om te onthullen hoe het enzym functioneert
- Wat is het belang van virtual reality voor artsen en chirurgen?
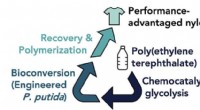
- Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken
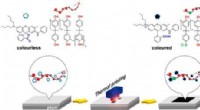
- Een stap in de richting van het kwijtraken van kassabonnen van BPA
- Eerste snapshots van ingesloten CO2-moleculen werpen nieuw licht op koolstofafvang

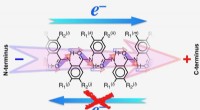
- Elektronen zetten één stap vooruit zonder twee stappen terug
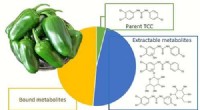
- Peperplant zuigt antibioticum voor persoonlijke verzorging op
 Hoe te gaan Garnalen in de Florida Intracoastal Waterway
Hoe te gaan Garnalen in de Florida Intracoastal Waterway Los Angeles en Google werken samen aan Tree Canopy-project
Los Angeles en Google werken samen aan Tree Canopy-project Waarom cellen zure lysosomen nodig hebben
Waarom cellen zure lysosomen nodig hebben  Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?
Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?  Welke soorten genen hebben plasmiden?
Welke soorten genen hebben plasmiden?  Als het binnenshuis 40°C wordt, is het beter om gebruik te maken van de lokale kennis van de bewoners dan de klimaatverandering van bovenaf te plannen
Als het binnenshuis 40°C wordt, is het beter om gebruik te maken van de lokale kennis van de bewoners dan de klimaatverandering van bovenaf te plannen  Een timmermansbijtje vinden
Een timmermansbijtje vinden Hoe u het verwachte gemiddelde in Statistics
Hoe u het verwachte gemiddelde in Statistics
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

