
Wetenschap
Hoe de moleculerformule van een verbinding wordt berekend als het emperisch bekend is?
Inzicht in de concepten
* Empirische formule: De eenvoudigste verhouding van het hele nummer van atomen in een verbinding.
* Moleculaire formule: Het werkelijke aantal atomen van elk element in een molecuul.
stappen om de moleculaire formule te berekenen
1. Bepaal de empirische formulemassa: Voeg de atomaire massa's van alle atomen in de empirische formule toe.
2. Bepaal de moleculaire massa: Dit wordt meestal in het probleem gegeven. U kunt het ook experimenteel vinden met behulp van technieken zoals massaspectrometrie.
3. Bereken de verhouding: Verdeel de moleculaire massa door de empirische formulemassa.
4. Vermenigvuldig de empirische formule: Vermenigvuldig de subscripts in de empirische formule met de verhouding die u in stap 3 hebt berekend. Dit geeft u de moleculaire formule.
Voorbeeld:
Laten we zeggen dat u een compound hebt met:
* Empirische formule: Ch₂o
* Moleculaire massa: 180 g/mol
1. Empirische formulemassa: (12.01 g/mol c) + (2 * 1.01 g/mol H) + (16,00 g/mol O) =30,03 g/mol
2. verhouding: 180 g/mol/30.03 g/mol ≈ 6
3. Moleculaire formule: Vermenigvuldig de subscripts in ch₂o met 6:c₆h₁₂o₆
Daarom is de moleculaire formule van de verbinding c₆h₁₂o₆ (glucose).
Key Points
* De moleculaire formule zal altijd een veelvoud van de empirische formule zijn.
* Als de moleculaire massa en empirische formulemassa hetzelfde zijn, is de empirische formule ook de moleculaire formule.
* U kunt de moleculaire formule gebruiken om de percentagesamenstelling te berekenen door massa van elk element in de verbinding.
 Klimaatwetenschappers bereiken ondubbelzinnige consensus over door de mens veroorzaakte opwarming in historisch rapport
Klimaatwetenschappers bereiken ondubbelzinnige consensus over door de mens veroorzaakte opwarming in historisch rapport Vijf feiten om je te helpen zee-ijs te begrijpen
Vijf feiten om je te helpen zee-ijs te begrijpen Waarom vrouwelijke motten groot en mooi zijn
Waarom vrouwelijke motten groot en mooi zijn  Wat is studie van ontwerp en doel in de natuur?
Wat is studie van ontwerp en doel in de natuur?  Onderzoekers bestuderen effecten van klimaatverandering op bodems bij militaire installaties
Onderzoekers bestuderen effecten van klimaatverandering op bodems bij militaire installaties
Hoofdlijnen
- Welke organellen worden beschouwd als het cellen recyclingscentrum?
- Wat is een medische plant?
- Wat is het masker van Anubis?
- Welke van deze organellen helpen planten hun energie te krijgen?
- Wat is de wetenschappelijke naam voor pilootwalvissen?
- Ontdekken hoe microben samenwerken
- Waarom zou een dode boom nog steeds biotisch facrerm zijn, zelfs dacht dat het niet meer leefde?
- Waarom worden bacterieën niet gebruikt in gentherapie?
- Hoe woorden hun betekenis krijgen
- Onverwachte nieuwe dynamiek voor grote DNA-moleculen in vloeibare suspensie

- Wetenschappers laten zien hoe ze een katalysator kunnen beheersen die een broeikasgas in een brandstof of grondstof verandert
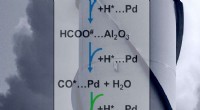
- Onderzoekers ontwikkelen nieuwe behandeling voor botinfectie met koperrijk glasimplantaat

- Doorbraak in snelle, massale screening op het ebolavirus

- Vaccin-ingrediënten kunnen zich verbergen in bibliotheken met kleine moleculen
 Nieuwe superlichtbron moet fascinerende inzichten in atomen mogelijk maken
Nieuwe superlichtbron moet fascinerende inzichten in atomen mogelijk maken Bereidheid om risico's te nemen - een persoonlijkheidskenmerk
Bereidheid om risico's te nemen - een persoonlijkheidskenmerk Waarom produceert een stereomicroscoop driedimensionaal beeld?
Waarom produceert een stereomicroscoop driedimensionaal beeld?  Machine learning-techniek reconstrueert beelden die door een multimode-vezel gaan
Machine learning-techniek reconstrueert beelden die door een multimode-vezel gaan Wat als mensen als vogels waren geëvolueerd?
Wat als mensen als vogels waren geëvolueerd?  NASA ontwikkelt een plan om personeel op suborbitale ruimtevaartuigen te laten vliegen
NASA ontwikkelt een plan om personeel op suborbitale ruimtevaartuigen te laten vliegen Weefselchips schieten naar het internationale ruimtestation
Weefselchips schieten naar het internationale ruimtestation Een benchmark voor circuits met één elektron
Een benchmark voor circuits met één elektron
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

