
Wetenschap
Wat gebeurt er met de elektronen wanneer een atoom van een kation en anion is?
kationen:
* verlies van elektronen: Een kation wordt gevormd wanneer een atoom * een of meer elektronen verliest.
* Positieve lading: Het verliezen van negatief geladen elektronen resulteert in een netto positieve lading op het atoom, waardoor een kation ontstaat.
* Voorbeeld: Natrium (NA) heeft één elektron in zijn buitenste schaal. Het verliest dit elektron om een natriumion (Na +) te vormen, dat een +1 lading heeft.
anionen:
* winst van elektronen: Een anion wordt gevormd wanneer een atoom * een of meer elektronen wint.
* Negatieve lading: Het verkrijgen van negatief geladen elektronen resulteert in een netto negatieve lading op het atoom, waardoor een anion ontstaat.
* Voorbeeld: Chloor (CL) heeft zeven elektronen in de buitenste schaal. Het krijgt één elektron om een chloride -ion (Cl-) te vormen, dat een -1 -lading heeft.
Het belangrijkste principe:octetregel
De vorming van kationen en anionen wordt vaak aangedreven door de wens van atomen om een stabiele elektronenconfiguratie te bereiken, meestal op de edelgassen. De "octetregel" stelt dat atomen de neiging hebben om elektronen te winnen, verliezen of delen om acht elektronen in hun buitenste schaal te hebben (behalve voor waterstof en helium, die de voorkeur geven aan twee).
ionische bindingen:
Kationen en anionen, vanwege hun tegengestelde aanklachten, worden tot elkaar aangetrokken. Deze elektrostatische aantrekkingskracht vormt een ionische binding , wat de basis is voor veel verbindingen.
Samenvattend:
* Kationen worden gevormd door elektronen te verliezen.
* Anionen worden gevormd door elektronen te winnen.
* De vorming van ionen wordt aangedreven door de octetregel en resulteert in een stabiele elektronenconfiguratie.
* Ionen met tegengestelde ladingen trekken elkaar aan en vormen ionische bindingen.
 Lab ontwikkelt grafeenelektrode met twee oppervlakken om water te splitsen in waterstof en zuurstof
Lab ontwikkelt grafeenelektrode met twee oppervlakken om water te splitsen in waterstof en zuurstof Onderzoekers ontwikkelen een zeer efficiënt kooldioxide-elektroreductiesysteem om de CO2-voetafdruk te verkleinen
Onderzoekers ontwikkelen een zeer efficiënt kooldioxide-elektroreductiesysteem om de CO2-voetafdruk te verkleinen  Een stap in de richting van het kwijtraken van kassabonnen van BPA
Een stap in de richting van het kwijtraken van kassabonnen van BPA In welke periode is koper gevonden?
In welke periode is koper gevonden?  Als u azijn verdunt, hoe zal dit de pH-waarde beïnvloeden?
Als u azijn verdunt, hoe zal dit de pH-waarde beïnvloeden?
Hoofdlijnen
- Hoe verwerven cellen homologe chromosoomparen die de allelen dragen, onafhankelijk diverteren?
- Wat is de relatie tussen exergonische reacties Endergonic en het gebruik van regeneratie van ATP?
- Welke bescherming van het sperma tegen bacteriën is de functie?
- Hoe cellen communiceren om als groep samen te bewegen
- Welk deel van de hersenen controleert emoties?
- Wat is het belang van cross-over in procesevolutie?
- Is beschimmeld brood eencellig of meercellig?
- Zebravissen laten zien hoe bio-elektriciteit de spierontwikkeling beïnvloedt
- Hoe een ‘evolutionaire speeltuin’ plantengenen bij elkaar brengt
- Hoogwaardige multimetalen kern-tussenlaag-schil icosahedrale elektrokatalysatoren voor ORR

- Mangaan kan eindelijk het katalysatorprobleem van waterstofbrandstofcellen oplossen
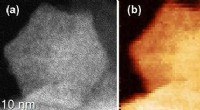
- Wetenschappers identificeren bioactieve stoffen in cacaobonen om medicijnen te ontwikkelen om skeletaandoeningen te bestrijden

- Onderzoekers onderzoeken de invloed van schimmelrot op de aroma's van most en wijn

- Biologische sensor kan glucosespiegels in speeksel nauwkeuriger en kostenefficiënter detecteren dan bloedonderzoek
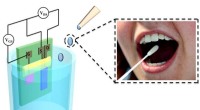
 DC naar wisselstroomomvormers bouwen
DC naar wisselstroomomvormers bouwen Welke vulkaan die de afgelopen tijd is uitgebroken?
Welke vulkaan die de afgelopen tijd is uitgebroken?  Onderzoekers ontdekken hoe en waar borsttumorcellen inactief worden, waardoor ze uitzaaien
Onderzoekers ontdekken hoe en waar borsttumorcellen inactief worden, waardoor ze uitzaaien  Hoeveel stippen heeft een elektronendotdiagram van een zwavelatoom?
Hoeveel stippen heeft een elektronendotdiagram van een zwavelatoom?  Hoe maak je een model van middelpuntzoekende kracht met behulp van waterbucktes?
Hoe maak je een model van middelpuntzoekende kracht met behulp van waterbucktes?  Hoeveel protonen neutronen en elektronen zijn er in koolstof 6?
Hoeveel protonen neutronen en elektronen zijn er in koolstof 6?  Afbeelding:Verlaten Venetiaanse lagune
Afbeelding:Verlaten Venetiaanse lagune March Madness bracket-analyse laat zien dat het kiezen van de laatste vier eerste leidt tot betere brackets
March Madness bracket-analyse laat zien dat het kiezen van de laatste vier eerste leidt tot betere brackets
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

