
Wetenschap
Wat is de relatie tussen structuur van een atoom- en atoomspectra?
1. Atomische structuur:
* elektronen in orbitalen: Atomen bestaan uit een positief geladen kern omgeven door negatief geladen elektronen die specifieke energieniveaus bezetten, bekend als orbitalen. Elk orbitaal komt overeen met een bepaalde energietoestand.
* Kwantummechanisch model: Het gedrag van elektronen wordt bepaald door de principes van de kwantummechanica. Elektronen bestaan in gekwantiseerde energietoestanden, wat betekent dat ze alleen discrete energieniveaus kunnen bezetten.
* overgangen van energieniveau: Wanneer een elektron energie absorbeert (bijvoorbeeld van warmte of licht), kan het naar een hoger energieniveau springen. Wanneer het terugkeert naar een lager energieniveau, geeft het de overtollige energie vrij als een foton van licht.
2. Atomic Spectra:
* emissiespectra: Wanneer atomen opgewonden zijn, stoten ze licht uit bij specifieke golflengten. Dit creëert een karakteristiek patroon van heldere lijnen die bekend staan als een emissiespectrum.
* Absorptiespectra: Wanneer licht door een monster van atomen gaat, worden bepaalde golflengten geabsorbeerd door de atomen, waardoor een patroon van donkere lijnen in het spectrum wordt veroorzaakt.
* Spectrale lijnen en energieniveaus: De golflengten van het uitgezonden of geabsorbeerde licht komen overeen met de energieverschillen tussen de elektronenergieniveaus.
verbinding:
De relatie ligt in het feit dat atomaire spectra een direct gevolg zijn van de gekwantiseerde energieniveaus van elektronen binnen een atoom .
* Elke spectrale lijn komt overeen met een specifieke energietransitie tussen twee elektronenergieniveaus.
* Het patroon van spectrale lijnen is uniek voor elk element, waardoor we elementen kunnen identificeren op basis van hun spectra.
Voorbeeld:
De felrode lijn in het waterstofspectrum komt overeen met de overgang van een elektron van het derde energieniveau (n =3) naar het tweede energieniveau (n =2). Deze overgang zendt een foton uit met een specifieke energie, overeenkomend met de golflengte van rood licht.
Samenvattend:
Atomische spectra komen voort uit de gekwantiseerde energieniveaus van elektronen in atomen. Het patroon van spectrale lijnen wordt bepaald door de specifieke energieverzamelingen die elektronen kunnen ondergaan. Met deze relatie kunnen we de structuur van atomen bestuderen door hun spectra te analyseren.
 Welk effect had het verwijderen van roofdieren op prooi?
Welk effect had het verwijderen van roofdieren op prooi?  Welke impulsen worden overgedragen door het reukvermogen?
Welke impulsen worden overgedragen door het reukvermogen?  Nieuw onderzoek schudt wat we wisten over de grote aardbeving in Idaho in 2020 die Boise trof
Nieuw onderzoek schudt wat we wisten over de grote aardbeving in Idaho in 2020 die Boise trof  Reconstructie van de instorting van de flank van Anak Krakatau die de Indonesische tsunami in december 2018 veroorzaakte
Reconstructie van de instorting van de flank van Anak Krakatau die de Indonesische tsunami in december 2018 veroorzaakte Twee doden bij orkaanachtige storm in Griekenland
Twee doden bij orkaanachtige storm in Griekenland
Hoofdlijnen
- De eerste gekweekte Chesapeake-zalm versus de laatste steur? Voorgestelde viskwekerij aan de oostkust wekt bezorgdheid op
- Het aantal genen in de mens is slechts 30000, maar het maakt miljoenen eiwitten hoe?
- Hoe vissers profiteren van de omgekeerde evolutie van kabeljauw
- De geometrie van seks:hoe lichaamsgrootte tot nieuwe soorten kan leiden
- Hoe ballistische valkaakmieren zelfvernietiging voorkomen met een perfecte onderkaakboog
- Tussen geometrie en biologie:hoe waarom is het aantal soorten afhankelijk van het gebied?
- Waarom orgaansysteem zuurstof naar cellen brengt?
- Waarom is de meeste grote vooruitgang in de mariene biologie de afgelopen 200 jaar gekomen?
- "Fingerprint Experiments
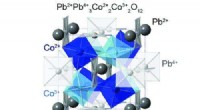
- Gemengde valentietoestanden in loodperovskieten
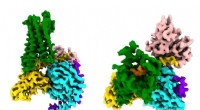
- CryoEM-onderzoek legt opioïde-signalering vast
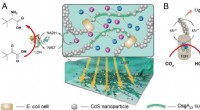
- Bacteriële biofilms vergemakkelijken biocompatibele bio-abiotische interfaces voor semi-kunstmatige fotosynthese
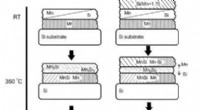
- Natuurkundigen houden toezicht op de vorming van hogere mangaansilicidefilms
- Kaas maken is afhankelijk van melkeiwitten om structuur te vormen

 Certificering van duurzame gewassen helpt mens en natuur, maar het zou meer kunnen doen om de armste boeren ter wereld te helpen
Certificering van duurzame gewassen helpt mens en natuur, maar het zou meer kunnen doen om de armste boeren ter wereld te helpen Welk mobiele telefoonsbedrijf biedt de gratis onbeperkte oproepen tussen 2 telefoons?
Welk mobiele telefoonsbedrijf biedt de gratis onbeperkte oproepen tussen 2 telefoons?  Studie biedt nieuwe verklaring voor neutrino-anomalieën op Antarctica
Studie biedt nieuwe verklaring voor neutrino-anomalieën op Antarctica Is er bij het blazen van lucht in een ballon sprake van duwen?
Is er bij het blazen van lucht in een ballon sprake van duwen?  Wat zijn vier soorten materie?
Wat zijn vier soorten materie?  De luchthaven van Miami wil je gezicht lezen. Daar word je misschien blij van
De luchthaven van Miami wil je gezicht lezen. Daar word je misschien blij van Hoe zag het zonnestelsel eruit voordat alle planeten migreerden?
Hoe zag het zonnestelsel eruit voordat alle planeten migreerden? Hoe je het makkelijker kunt maken om plantenafval om te zetten in biobrandstoffen
Hoe je het makkelijker kunt maken om plantenafval om te zetten in biobrandstoffen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

