
Wetenschap
Als de elementen van het periodieke tabel door dichtheid worden gesequenced van de kleinste tot de grootste, wat zouden ze gemeen hebben vergelijkbare chemische en fysische eigenschappen?
Dit is waarom:
* Dichtheid wordt beïnvloed door meerdere factoren: Dichtheid is een functie van massa en volume. Hoewel de atomaire massa in het algemeen toeneemt naarmate u over en neer in het periodiek systeem beweegt, verandert de atoomgrootte (volume) ook op complexe manieren. Dit betekent:
* Elementen in dezelfde periode (rij) kunnen drastisch verschillende dichtheden hebben vanwege verschillen in atomaire grootte.
* Elementen in dezelfde groep (kolom) kunnen ook verschillende dichtheden hebben, opnieuw vanwege de manier waarop atomaire grootte van een groep verandert.
* chemische en fysische eigenschappen worden bepaald door elektronenconfiguratie: De chemische en fysische eigenschappen van elementen worden voornamelijk bepaald door hun elektronenconfiguratie, met name het aantal en de opstelling van valentie -elektronen (elektronen in de buitenste schaal).
Laten we illustreren met voorbeelden:
* lithium (Li) vs. beryllium (BE): Li is minder dicht dan zijn, hoewel een hogere atoommassa is. Dit komt omdat Li een grotere atoomradius heeft.
* Osmium (OS) vs. Mercury (Hg): Osmium is het dichtste element, terwijl kwik een vloeistof is bij kamertemperatuur. Dit verschil in dichtheid wordt voornamelijk aangedreven door hun enorm verschillende elektronenconfiguraties en hoe ze interageren om bindingen te vormen.
Conclusie: Hoewel dichtheid een nuttige eigenschap is, correleert het niet direct met de chemische en fysische eigenschappen die worden gedefinieerd door elektronenconfiguratie. Het regelen van elementen per dichtheid zou geen duidelijk patroon van soortgelijk gedrag onthullen.
 Welke van de volgende is een organisch molecuul?
Welke van de volgende is een organisch molecuul?  Hoe verhoudt kooldioxide zich tot de temperatuur?
Hoe verhoudt kooldioxide zich tot de temperatuur?  Wat zou een fysieke verandering zijn metaal roesten zilver aangetast water koken of papierverbranding?
Wat zou een fysieke verandering zijn metaal roesten zilver aangetast water koken of papierverbranding?  Chemicaliënvrij, goedkope opbergzakken voor gewassen die voedsel langer bewaren nu in de handel verkrijgbaar
Chemicaliënvrij, goedkope opbergzakken voor gewassen die voedsel langer bewaren nu in de handel verkrijgbaar Bij experimenten op aarde, mogelijke bouwstenen van buitenaards leven testen
Bij experimenten op aarde, mogelijke bouwstenen van buitenaards leven testen
Hoofdlijnen
- Wat zijn drie dingen die een bloem maakt om het zaden te huisvesten?
- Wat is een scroutum?
- Wat gebeurt er als te veel schadelijke bacteriën het systeem binnenkomen?
- Waarom hebben cellen voedsel nodig?
- Hoe klimaatverandering planten onder druk zet en hun groei verandert
- Wat moet de wetenschapper doen als zijn hypothese niet correct is?
- Wat is controle in wetenschappelijke termen?
- Hoe wordt een wetenschappelijke hypothese geëvalueerd?
- Vervagende lichten:uitgebreid onderzoek onthult meerdere bedreigingen voor de vuurvliegpopulaties in Noord-Amerika
- Onderzoekers kweken het meest levensechte bot tot nu toe uit geweven cellen
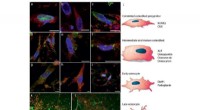
- Onderzoekers vinden dat intermoleculaire krachten clusters stabiliseren, aërosolproductie bevorderen

- Kleurstoffen detecteren ziekte door hartslagsignalen

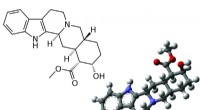
- De 3D-vorm van moleculen ontdekken met een druk op de knop
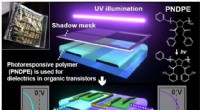
- Flexibele circuits afstemmen met licht
 AC of DC? Twee nieuw beschreven elektrische vissen uit de Amazone zijn anders bedraad
AC of DC? Twee nieuw beschreven elektrische vissen uit de Amazone zijn anders bedraad  Een pH van wordt als neutraal beschouwd.?
Een pH van wordt als neutraal beschouwd.?  Onderzoekers verklaren het mechanisme achter het proces dat de efficiëntie van organische zonnecellen kan verhogen
Onderzoekers verklaren het mechanisme achter het proces dat de efficiëntie van organische zonnecellen kan verhogen Onderzoekers laten zien hoe magnetisme actief kan worden veranderd door druk
Onderzoekers laten zien hoe magnetisme actief kan worden veranderd door druk  Leerachtige materialen maken van schimmels
Leerachtige materialen maken van schimmels De Amerikaanse Drought Monitor is een cruciaal instrument voor het dorre Westen:kan het de klimaatverandering bijhouden?
De Amerikaanse Drought Monitor is een cruciaal instrument voor het dorre Westen:kan het de klimaatverandering bijhouden?  Make-up & Science Fair Ideas
Make-up & Science Fair Ideas Coronavirus moet ons hoop geven dat we de klimaatcrisis het hoofd kunnen bieden
Coronavirus moet ons hoop geven dat we de klimaatcrisis het hoofd kunnen bieden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

