
Wetenschap
Waarom heeft magnesium een lager smelt- en kookpunt dan calciumstrontium andere leden die onder magnesium aanwezig zijn?
Metallic binding en effectieve nucleaire lading
* Metallic binding: Metalen worden bij elkaar gehouden door een "zee" van gedelokaliseerde elektronen. De sterkte van deze metalen binding wordt bepaald door de aantrekkingskracht tussen de positief geladen metaalionen en de negatief geladen elektronenzee.
* Effectieve nucleaire lading (Zeff): De effectieve nucleaire lading is de netto positieve lading die door een elektron in een atoom wordt ervaren. Het wordt beïnvloed door het aantal protonen in de kern (atoomnummer) en het afschermingseffect van binnenste elektronen.
Verklaring voor het lagere smelt- en kookpunt van Magnesium:
1. kleinere atoomradius: Magnesium heeft een kleinere atoomradius dan calcium, strontium en de elementen eronder. Dit betekent dat de valentie -elektronen dichter bij de kern zijn.
2. Zwakkere metalen binding: De kleinere atoomradius van magnesium resulteert in zwakkere metalen binding om de volgende redenen:
* Verminderde elektronendelocalisatie: De valentie -elektronen in magnesium worden nauwer vastgehouden door de kern, waardoor ze minder gemakkelijk gedelocaliseerd zijn.
* Lagere elektronendichtheid: Met kleinere atomen is de elektronendichtheid in de metalen zee lager, wat leidt tot een zwakkere elektrostatische aantrekkingskracht tussen de positieve ionen en de elektronen.
3. Lagere effectieve nucleaire lading: Hoewel magnesium een hoger atoomnummer heeft dan beryllium, bevinden de valentie -elektronen zich in een hoger energieniveau (3S) in vergelijking met Beryllium's (2S). Dit betekent dat ze een lagere effectieve nucleaire lading ervaren, wat leidt tot zwakkere aantrekkingskracht en zwakkere metalen binding.
Samenvatting:
De combinatie van magnesiums kleinere atoomradius, zwakkere metalen binding en lagere effectieve nucleaire lading resulteert in zwakkere interatomische krachten, wat leidt tot lagere smelten- en kookpunten in vergelijking met calcium, strontium en de andere elementen eronder in groep 2.
 Een natte winter, een drassige lente:de negatieve dipool in de Indische Oceaan
Een natte winter, een drassige lente:de negatieve dipool in de Indische Oceaan Waarom kan de verwijdering van één belangrijke soort een heel ecosysteem beïnvloeden?
Waarom kan de verwijdering van één belangrijke soort een heel ecosysteem beïnvloeden?  NASA-satelliet vindt tropische storm Wipha over de Golf van Tonkin
NASA-satelliet vindt tropische storm Wipha over de Golf van Tonkin Vluchten wereldwijd lopen verhoogd risico op ernstige turbulentie als gevolg van klimaatverandering
Vluchten wereldwijd lopen verhoogd risico op ernstige turbulentie als gevolg van klimaatverandering Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen
Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen
Hoofdlijnen
- Stimulering van plantengroei door hoge CO2 hangt af van fosforhomeostase in chloroplasten
- Hoe eindigt de transcriptie?
- Containergebaseerde methode lost problemen op bij het recirculeren van viskweek
- Wilde vissen gedijen ondanks hopeloze monstermutaties, volgens onderzoek
- Welke lichaamssystemen werken samen om voedingsstoffen naar de cellen te brengen?
- Wat zijn de meest primitieve organismen die tegenwoordig een structuur hebben die te simpel is als cellen.?
- Wetenschappers lokaliseren jaloezie in de monogame geest
- Onderzoekers passen gist aan om te laten zien hoe planten reageren op een belangrijk hormoon
- Welke vormen tussen de verdeelde kern tijdens cytokenesis in plantencellen?
- Metaal vereenvoudigt de synthese van antilichaamgeneesmiddelen
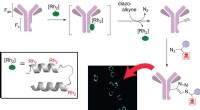
- Surface-enhanced Raman-spectroscopiemethode realiseert kwantitatieve detectie van geneesmiddelen tegen kanker in serum
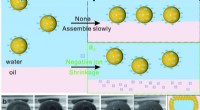
- Stuiterende bubbels schudden emulsiestudies op

- Nieuwe mogelijkheden voor lichtgevende kunststoffen met patroonlicht

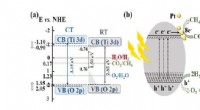
- Nieuwe fotokatalysator versnelt de omzetting van kooldioxide in chemische hulpbronnen
 Aboriginals leefden in het binnenland van de woestijn van Australië 50, 000 jaar geleden, eerder dan eerst gedacht
Aboriginals leefden in het binnenland van de woestijn van Australië 50, 000 jaar geleden, eerder dan eerst gedacht Tesla en Ford handelen uitdagingen in macho-vrachtwagenwereld
Tesla en Ford handelen uitdagingen in macho-vrachtwagenwereld Als grafeen spreekt, kunnen wetenschappers nu luisteren
Als grafeen spreekt, kunnen wetenschappers nu luisteren Een schilderserfgoed behouden met nanomaterialen
Een schilderserfgoed behouden met nanomaterialen Omleidingen van de Mississippi-rivier:landwinst of -verlies?
Omleidingen van de Mississippi-rivier:landwinst of -verlies?  Ivorenmaffia:hoe criminele bendes de Afrikaanse olifanten vermoorden
Ivorenmaffia:hoe criminele bendes de Afrikaanse olifanten vermoorden  Welke objecten zou u gebruiken om een toename van het volume te beschrijven?
Welke objecten zou u gebruiken om een toename van het volume te beschrijven?  Team ontwikkelt zeer efficiënte methode voor het creëren van flexibele, transparante elektroden
Team ontwikkelt zeer efficiënte methode voor het creëren van flexibele, transparante elektroden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

