
Wetenschap
Welke conclusie kunt u trekken met betrekking tot de polariteit van koolwaterstoffen?
* Samenstelling: Koolwaterstoffen bestaan uit alleen koolstof- en waterstofatomen. Zowel koolstof als waterstof hebben vergelijkbare elektronegativiteitswaarden, wat betekent dat ze elektronen redelijk gelijkmatig in hun bindingen delen.
* binding: De C-H-bindingen binnen koolwaterstoffen zijn in wezen niet-polaire covalente bindingen. Dit betekent dat er geen significant verschil is in elektronendichtheid tussen de koolstof- en waterstofatomen.
* Vorm: De vorm van koolwaterstofmoleculen speelt ook een rol. Lineaire en vertakte koolwaterstoffen hebben symmetrische vormen, wat verder bijdraagt aan hun niet -polaire aard.
Er zijn echter enkele uitzonderingen:
* onverzadigde koolwaterstoffen: Koolwaterstoffen met dubbele of drievoudige bindingen (zoals alkenes en alkynes) kunnen een polair karakter hebben vanwege de elektronendichtheid rond de dubbele of drievoudige binding.
* Grote, complexe koolwaterstoffen: Zeer grote koolwaterstoffen met unieke vormen of functionele groepen (zoals aromatische ringen) kunnen enige polariteit vertonen.
Samenvattend:
Hoewel de meeste koolwaterstoffen als niet -polair worden beschouwd vanwege hun samenstelling en bindingstypen, zijn er uitzonderingen waarbij factoren zoals onverzadiging of structurele complexiteit tot een zekere mate van polariteit kunnen leiden.
 Wat is analogie tussen rood tot oranje als blauw?
Wat is analogie tussen rood tot oranje als blauw?  Zou u een stof definiëren als een verbinding of als een mengsel van een element?
Zou u een stof definiëren als een verbinding of als een mengsel van een element?  Vriespunt van water in vergelijking met een zoutoplossing
Vriespunt van water in vergelijking met een zoutoplossing Hoe heeft het periodiek systeem wetenschappers geholpen elementen beter te begrijpen?
Hoe heeft het periodiek systeem wetenschappers geholpen elementen beter te begrijpen?  Waarom is de waterige oplossing van permanganaat niet volledig stabiel?
Waarom is de waterige oplossing van permanganaat niet volledig stabiel?
Hoofdlijnen
- In welke stadium van een cellencyclus staat de gerepliceerde chromosomen op de evenaarcel?
- Wat is het RNA van een plantencel?
- Wat doen wetenschappers om hen te helpen hypothesen te maken?
- 'Vis'-aanwijzing helpt vaststellen hoe eiwitten evolueren
- Welke rol speelt water in de voedselproductie van planten?
- Waarom hebben planten een gezond wortelsysteem nodig voor fotosynthese?
- Wat is de complementaire basispaarregel?
- Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?
- Welke term wordt gedefinieerd als een molecuul gevormd door twee monosachariden?
- Het onzichtbare spotten
- Beoordeling van de overleving in de lucht van bacteriën in aerosoldruppels van hoesten en niezen

- Studie onthult beperkingen van de methode voor het bepalen van de eiwitstructuur
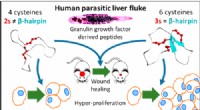
- Een molecuul geproduceerd door een Thaise leverparasiet zou de oplossing kunnen zijn voor die niet-genezende wonden
- Snelle identificatie van hoogwaardige, katalysatoren met meerdere elementen

 Natuurkunde:niet alles is waar het lijkt te zijn
Natuurkunde:niet alles is waar het lijkt te zijn Plastic afval heeft enig economisch voordeel voor ontwikkelingslanden
Plastic afval heeft enig economisch voordeel voor ontwikkelingslanden Hoe reageren consumenten als vrienden slechte service verlenen in een zakelijke overeenkomst?
Hoe reageren consumenten als vrienden slechte service verlenen in een zakelijke overeenkomst?  Wat is de STP voor zuurstof?
Wat is de STP voor zuurstof?  Wat is de chemische formule die hydrocultuurplanten kan verklaren?
Wat is de chemische formule die hydrocultuurplanten kan verklaren?  Een mobiele overstromingstool voor de natie onthuld
Een mobiele overstromingstool voor de natie onthuld Open en gesloten pijp (fysica): verschillen, resonantie en vergelijking
Open en gesloten pijp (fysica): verschillen, resonantie en vergelijking  Wat is de diameter van de aarde in vergelijking met Uranus?
Wat is de diameter van de aarde in vergelijking met Uranus?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

