
Wetenschap
Waarom is de waterige oplossing van permanganaat niet volledig stabiel?
1. Ontleding door licht:
* Permanganaationen zijn gevoelig voor licht, vooral UV -licht.
* Licht bevordert de reductie van permanganaationen (MNO₄⁻) tot mangaandioxide (MNO₂), een bruin neerslag.
* Dit is de reden waarom permanganaatoplossingen meestal worden opgeslagen in donkerbruine flessen om blootstelling aan licht te minimaliseren.
2. Reactie met reductiemiddelen:
* Permanganaationen zijn sterke oxidatiemiddelen, wat betekent dat ze gemakkelijk elektronen uit andere stoffen accepteren.
* Zelfs trace -hoeveelheden reducerende middelen (bijv. Organische stof, stofdeeltjes, opgeloste gassen) in de oplossing kunnen reageren met permanganaat, wat leidt tot de ontleding ervan.
* Dit verklaart waarom oplossingen die voor langere periodes zijn opgeslagen vaak een lichte verkleuring of neerslagvorming vertonen.
3. PH -wijzigingen:
* Permanganaatoplossingen zijn het meest stabiel in enigszins alkalische omstandigheden (pH 9-10).
* In zure oplossingen wordt de vermindering van permanganaat tot mangaan (II) ionen (Mn²⁺) de voorkeur.
* In sterk alkalische oplossingen kan de vorming van manganaationen (mno₄²⁻) optreden, wat leidt tot kleurveranderingen.
4. Temperatuur:
* Hogere temperaturen versnellen de ontledingssnelheid van permanganaat.
* Dit komt omdat verhoogde kinetische energie de botsing van moleculen bevordert, waardoor de kans op chemische reacties wordt vergroot.
5. Aanwezigheid van katalysatoren:
* Bepaalde stoffen kunnen als katalysatoren fungeren en de ontleding van permanganaat versnellen.
* De aanwezigheid van mangaan (II) ionen kan bijvoorbeeld de vermindering van permanganaat katalyseren.
Over het algemeen:
De instabiliteit van waterige permanganaatoplossingen komt voort uit zijn sterke oxiderende aard, de gevoeligheid ervan voor licht en de gevoeligheid voor reacties met reducerende middelen en pH -veranderingen. Om de stabiliteit te maximaliseren, is het essentieel om de oplossingen in donkerbruine flessen op te slaan, weg van direct zonlicht, in een koele en donkere omgeving.
Opmerking: Hoewel permanganaatoplossingen niet helemaal stabiel zijn, kunnen ze nog steeds behoorlijk nuttig zijn voor verschillende toepassingen, zoals titraties, oxidaties en desinfectiemiddelen. Het is echter cruciaal om op de hoogte te zijn van hun beperkingen en passende voorzorgsmaatregelen te nemen om hun stabiliteit te waarborgen.
 Hoe kwam alkaliteit in water terecht?
Hoe kwam alkaliteit in water terecht?  Nieuwe wasmiddelen voor geneesmiddelenonderzoek
Nieuwe wasmiddelen voor geneesmiddelenonderzoek Onderzoekers bereiken gastgestuurde zelfassemblage en chirale inductie van fotofunctionele lanthanide-tetraëdrische kooien
Onderzoekers bereiken gastgestuurde zelfassemblage en chirale inductie van fotofunctionele lanthanide-tetraëdrische kooien Zodra we de CO2-uitstoot kunnen opvangen, dit is wat we ermee kunnen doen
Zodra we de CO2-uitstoot kunnen opvangen, dit is wat we ermee kunnen doen Onderzoekers maken de weg vrij voor grootschalige, efficiënte organische zonnecellen met waterbehandeling
Onderzoekers maken de weg vrij voor grootschalige, efficiënte organische zonnecellen met waterbehandeling
 Om de toekomst van poolijs te voorspellen, milieuwetenschappers kijken naar het verleden
Om de toekomst van poolijs te voorspellen, milieuwetenschappers kijken naar het verleden Drie redenen waarom orkaan Ian een groot overstromingsgevaar vormt voor Florida:een meteoroloog legt uit
Drie redenen waarom orkaan Ian een groot overstromingsgevaar vormt voor Florida:een meteoroloog legt uit Waarom heeft de oceaan verschillende kleuren op verschillende plaatsen?
Waarom heeft de oceaan verschillende kleuren op verschillende plaatsen?  Uit onderzoek blijkt dat boeren in Pennsylvania veel hebben gedaan om de waterkwaliteit van Chesapeake Bay te beschermen
Uit onderzoek blijkt dat boeren in Pennsylvania veel hebben gedaan om de waterkwaliteit van Chesapeake Bay te beschermen Dingen die wespen en bijen eten
Dingen die wespen en bijen eten
Hoofdlijnen
- Wat is de wetenschappelijke naam voor root haarcel?
- Hoe plantencellen het potentieel voor zelfbeschadiging neutraliseren
- Welke 4 chemicaliën vormen DNA -strengen?
- Wat gebruiken wetenschappers met hun experimenten?
- Een gevolg van genetische drift is?
- Wat is de relatie tussen planten en zuurstof?
- Nieuw boek van biologen beschrijft een nieuw tijdperk in de studie van evolutie
- Waar zou je een cel vinden die een groot aantal chloroplasten bevatte?
- Waar is een hypothese op gebaseerd?
- Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten
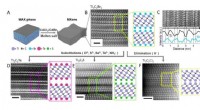
- Het begrijpen van bederf- en kwaliteitsproblemen kan de Amerikaanse ambachtelijke kaasindustrie verbeteren

- Nieuwe materialen vertonen een gespleten persoonlijkheid

- Een nieuwe brandstofcel-elektrolyt

- Het nieuwe groene alternatief voor de productie van medicijnen
 Hoe wordt regenval gemeten in het metrische systeem?
Hoe wordt regenval gemeten in het metrische systeem?  Wetenschappers mobiliseren terwijl het bleken op Great Barrier Reef wordt hervat
Wetenschappers mobiliseren terwijl het bleken op Great Barrier Reef wordt hervat Meststof Vervuiling van Aquatische Ecosystemen
Meststof Vervuiling van Aquatische Ecosystemen Hoe wordt luchtweerstand ook wel genoemd?
Hoe wordt luchtweerstand ook wel genoemd?  Wat gebeurt er als zout wordt toegevoegd aan water?
Wat gebeurt er als zout wordt toegevoegd aan water?  Oceanografen hebben een verklaring voor de raadselachtige oceaanturbulentie in het Noordpoolgebied
Oceanografen hebben een verklaring voor de raadselachtige oceaanturbulentie in het Noordpoolgebied Eerste gedetailleerde kijk op hoe ladingsoverdracht de structuur van een molecuul vervormt
Eerste gedetailleerde kijk op hoe ladingsoverdracht de structuur van een molecuul vervormt Hoe virussen hun gastheercellen te slim af zijn
Hoe virussen hun gastheercellen te slim af zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

