
Wetenschap
Waarom is Polar Revalent Bonds belangrijk?
1. Water's unieke eigenschappen:
* Universeel oplosmiddel: Polaire watermoleculen kunnen veel stoffen oplossen vanwege hun vermogen om waterstofbruggen te vormen met andere polaire moleculen. Dit is cruciaal voor het leven, waardoor het transport van voedingsstoffen en het verwijderen van afvalproducten mogelijk is.
* Hoog kookpunt: De sterke waterstofbruggen tussen watermoleculen vereisen veel energie om te breken, wat resulteert in een relatief hoog kookpunt. Dit maakt vloeibaar water overvloedig op het aardoppervlak.
* Uitstekende warmtecapaciteit: Het vermogen van water om warmte efficiënt te absorberen en op te slaan helpt de temperatuur te reguleren, wat essentieel is voor de processen van het leven.
2. Biologische moleculen:
* Eiwitstructuur en functie: Aminozuren, de bouwstenen van eiwitten, worden bij elkaar gehouden door peptidebindingen, die polaire covalente bindingen zijn. De vorm en functie van eiwitten worden bepaald door hun unieke volgorde van aminozuren en de interacties daartussen.
* DNA en RNA: De nucleotiden die DNA en RNA vormen, worden bij elkaar gehouden door polaire covalente bindingen (fosfodiesterbindingen). De unieke sequentie van nucleotiden bepaalt de genetische informatie die is opgeslagen in deze moleculen.
* Enzym -activiteit: Enzymen, die biologische reacties katalyseren, gebruiken vaak polaire covalente bindingen om te interageren met hun substraten en chemische transformaties te vergemakkelijken.
3. Chemische reacties:
* Oplosbaarheid: Polaire moleculen hebben de neiging om op te lossen in polaire oplosmiddelen (zoals water), terwijl niet -polaire moleculen oplossen in niet -polaire oplosmiddelen (zoals olie). Dit verschil in oplosbaarheid stimuleert vele chemische reacties en processen.
* Reactiviteit: De ongelijke delen van elektronen in polaire covalente bindingen creëert gebieden met gedeeltelijke positieve en negatieve lading, waardoor deze moleculen reactiever zijn dan niet -polaire moleculen.
4. Materiaaleigenschappen:
* Fysieke eigenschappen: Polaire covalente bindingen dragen bij aan het smeltpunt, het kookpunt en de oplosbaarheid van een molecuul, die zijn toestand en gedrag beïnvloeden.
* Elektrische eigenschappen: Polaire moleculen kunnen tot op zekere hoogte elektriciteit leiden vanwege de scheiding van lading. Dit is relevant voor toepassingen zoals batterijen en elektronische apparaten.
Samenvattend, Polaire covalente bindingen spelen een cruciale rol bij het vormgeven van de eigenschappen van materie, het stimuleren van chemische reacties en het mogelijk maken van de ingewikkelde levensprocessen. Hun impact strekt zich uit van de eenvoudige handeling van het oplossen van suiker in water tot het complexe werking van ons lichaam.
 Waarom goed nog afval nodig hebben in een circulaire economie
Waarom goed nog afval nodig hebben in een circulaire economie Nieuw onderzoek schetst waarom Zuid-Afrikaans-Amerikaanse boseigenaren minder snel gebruik zullen maken van federale hulp
Nieuw onderzoek schetst waarom Zuid-Afrikaans-Amerikaanse boseigenaren minder snel gebruik zullen maken van federale hulp  Bourgondische wijndruiven vertellen het klimaatverhaal en laten zien dat de opwarming de afgelopen dertig jaar is versneld
Bourgondische wijndruiven vertellen het klimaatverhaal en laten zien dat de opwarming de afgelopen dertig jaar is versneld  Uitleg over thermische getijden in de bovenste atmosfeer tijdens de El Niño . van 2015
Uitleg over thermische getijden in de bovenste atmosfeer tijdens de El Niño . van 2015 Leven in de droogste woestijn ter wereld gezien als teken van mogelijk leven op Mars
Leven in de droogste woestijn ter wereld gezien als teken van mogelijk leven op Mars
Hoofdlijnen
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- Welke indicatoren worden gebruikt voor elk molecuul eenvoudige suikers zetmeel lipiden eiwitten?
- Hoe breuken in DNA worden gerepareerd
- Eerste celkaart van 20, 000 cellen in zoogdierembryo
- Artefacten suggereren aankomst van mensen in Australië 18,
- Welke veranderingen in de cellulaire ademhaling kun je verwachten in slapende zaden?
- Wat heeft enzymen om cellen te helpen vernietigen?
- Molecuul dat een aminozuur naar het ribosoom draagt voor opname in een eiwit?
- Chimpansees en roetzwarte mangabeys verstoren de relaties van andere groepsleden
- De mechanismen van verbeterde verdampingsflux door nanokanalen

- Een nieuwe cermet die een betere warmte-uitwisseling voor zonne-energiecentrales zou kunnen bieden

- Lab verandert fluorescerende tags in kankermoordenaars
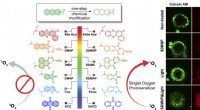
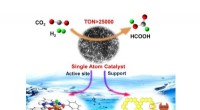
- Katalysator met één atoom gebaseerd op homogeen katalyse-prototype voor CO2-transformatie
- Onderzoek kan ertoe bijdragen dat flexibele technologie langer meegaat, vermijd kritieke storingen

 Is Amerika de maan gehaald?
Is Amerika de maan gehaald?  Supersnelle bewaking in zonnecellen betrapt recombinatie op heterdaad
Supersnelle bewaking in zonnecellen betrapt recombinatie op heterdaad Hoe enorme overstromingen en complexe infrastructuur de ondergang van het oude Angkors hadden kunnen veroorzaken?
Hoe enorme overstromingen en complexe infrastructuur de ondergang van het oude Angkors hadden kunnen veroorzaken? Wetenschappers ontdekken hoe vreemden van vampiervleermuizen vrienden maken
Wetenschappers ontdekken hoe vreemden van vampiervleermuizen vrienden maken  Wat is een eenvoudige suiker zoals glucose of fructose en zijn de bouwstenen voor koolhydraten?
Wat is een eenvoudige suiker zoals glucose of fructose en zijn de bouwstenen voor koolhydraten?  Tropische storm let op in Guam, NASA ziet 02W-vorm
Tropische storm let op in Guam, NASA ziet 02W-vorm Hellingstabiliteitsmodel kan aardverschuivingen helpen voorspellen om gemeenschappen te beschermen, Red levens
Hellingstabiliteitsmodel kan aardverschuivingen helpen voorspellen om gemeenschappen te beschermen, Red levens Hoe ontdekten wetenschappers pangea?
Hoe ontdekten wetenschappers pangea?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

