
Wetenschap
Wat is de overvloed aan een isotoopatomaire massa 64.9278?
* isotopen hebben hetzelfde aantal protonen maar verschillende aantallen neutronen. Dit betekent dat de atoommassa een aanwijzing kan zijn voor de identiteit van de isotoop, maar het is niet genoeg.
* overvloed verwijst naar het relatieve percentage van een isotoop in een natuurlijk voorkomend monster. Om dit te bepalen, moet u weten:
* het element: Naar welk element behoort deze isotoop? (bijv. Koper, zink, enz.)
* Andere isotopen van dat element: Elementen hebben vaak meerdere isotopen. Je moet de atomaire massa's van deze andere isotopen en hun relatieve overvloed kennen.
Voorbeeld:
Laten we zeggen dat u op zoek bent naar de overvloed van de isotoop met massa 64.9278 in koper (cu) . Dit is wat je moet doen:
1. Identificeer de isotopen van koper: Koper heeft twee hoofdisotopen:Cu-63 en Cu-65.
2. Vind hun atoommassa: Cu-63 heeft een massa van 62.9296 AMU en CU-65 heeft een massa van 64.9278 AMU.
3. Bepaal hun relatieve overvloed: De overvloed aan Cu-63 is ongeveer 69,17%en de overvloed aan Cu-65 is ongeveer 30,83%.
Daarom is de overvloed van de isotoop met atoommassa 64.9278 (CU-65) ongeveer 30,83%.
Geef het element of andere informatie op om de overvloed van de isotoop te bepalen met atoommassa 64.9278.
 2 tropische stormen op weg naar een dubbele klap naar de Amerikaanse Golfkust
2 tropische stormen op weg naar een dubbele klap naar de Amerikaanse Golfkust Hoe vindt een wolf eten?
Hoe vindt een wolf eten?  Duurzame aanvoer van mineralen en metalen sleutel tot koolstofarme energietoekomst
Duurzame aanvoer van mineralen en metalen sleutel tot koolstofarme energietoekomst Nachtvlinders met markeringen van een kruis op Wings
Nachtvlinders met markeringen van een kruis op Wings Brandbestrijding bederft de aarde. Californische bemanningen zijn het aan het repareren
Brandbestrijding bederft de aarde. Californische bemanningen zijn het aan het repareren
Hoofdlijnen
- Onthul de mysteries van celdeling in embryo's met timelapse-fotografie
- Wat zorgt ervoor dat het slijm groeit in een donkere wetenschappelijke verklaring?
- Wat draagt het meest bij aan de vervuiling?
- Waar in de cel zijn vetzuren normaal geoxideerd?
- Hoe bacteriën cellulaire lading vervoeren door langs eiwitten te 'surfen'
- Waarom verschilt de kleur van twee groepencellen?
- Welk deel haalt gember uit de plant?
- Waarom is uw DNA 75 procent vergelijkbaar met die van een fruitvlieg?
- Studie vindt potentiële celreceptoren om antibioticaresistentie te verminderen
- Nieuwe kooldioxide-adsorberende kristallen voor biomedische materialen die afhankelijk zijn van vormgeheugeneffect
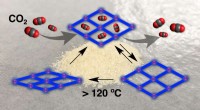
- Fotokatalytische vorming van zeer reactieve alkynen onder zichtbaar licht
- Superadsorberende MOF vangt tweemaal zijn gewicht op in water

- Ontwikkeling van een nieuwe eindfunctionalisatietechniek in polymeersynthese
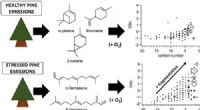
- Bladluis-gestresste dennen vertonen verschillende secundaire organische aerosolvorming
 Wat is BPA en waarom zit het in zoveel plastic producten?
Wat is BPA en waarom zit het in zoveel plastic producten? Gebouwen wereldwijd koelen
Gebouwen wereldwijd koelen Afronden naar de grootste plaats Waarde
Afronden naar de grootste plaats Waarde Fornax Een sterrenstelsel onderzocht met AstroSat
Fornax Een sterrenstelsel onderzocht met AstroSat Muon-bundelanalyse van organisch materiaal in monsters uit de ruimte
Muon-bundelanalyse van organisch materiaal in monsters uit de ruimte Wat zijn de drie manieren waarop warmte wordt overgedragen?
Wat zijn de drie manieren waarop warmte wordt overgedragen?  Hoe komt het dat een stollingsgesteente bestaat uit grote kristallen en kleine kristallen?
Hoe komt het dat een stollingsgesteente bestaat uit grote kristallen en kleine kristallen?  Hoe doe je wiskunde met je vingers
Hoe doe je wiskunde met je vingers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

