
Wetenschap
Welk deel van een evenwichtige chemische vergelijking geeft informatie over de relatieve getallen molreactanten en -producten omvatten een reactie?
Dit is waarom:
* stoichiometrie: De studie van de kwantitatieve relaties tussen reactanten en producten in chemische reacties.
* coëfficiënten: De getallen geschreven voor elke chemische formule in een evenwichtige vergelijking.
* mol: Een meeteenheid die een specifiek aantal deeltjes vertegenwoordigt (6.022 x 10 23 ).
Voorbeeld:
De evenwichtige vergelijking voor de verbranding van methaan is:
CH 4 + 2o 2 → CO 2 + 2H 2 O
* coëfficiënten: 1, 2, 1, 2
* interpretatie: Deze vergelijking vertelt ons dat:
* 1 mol methaan (CH 4 ) reageert met 2 mol zuurstof (o 2 ))
* Om 1 mol kooldioxide te produceren (CO 2 ) en 2 mol water (H 2 O)
Sleutelpunten:
* De coëfficiënten vertegenwoordigen het * relatieve * aantal mol, niet de werkelijke hoeveelheden die in een specifieke reactie worden gebruikt.
* Het in evenwicht brengen van een chemische vergelijking zorgt ervoor dat het aantal atomen van elk element aan beide kanten hetzelfde is en die voldoet aan de wet van het behoud van massa.
Door de stoichiometrische coëfficiënten te begrijpen, kunnen we de hoeveelheid reactanten en producten voorspellen die betrokken zijn bij een reactie, wat cruciaal is voor het uitvoeren van chemische reacties en berekeningen.
 Klimaatverandering kan El Nino in de Indische Oceaan doen ontwaken
Klimaatverandering kan El Nino in de Indische Oceaan doen ontwaken Waarom klimaatverandering een heroverweging van koffie- en cacaoproductiesystemen betekent
Waarom klimaatverandering een heroverweging van koffie- en cacaoproductiesystemen betekent  Digitale gegevens van bewaarde planten en dieren veranderen de manier waarop wetenschappers de wereld verkennen
Digitale gegevens van bewaarde planten en dieren veranderen de manier waarop wetenschappers de wereld verkennen  Te schattig om te doden? Amerikaanse verdeeldheid over herten in de voorsteden
Te schattig om te doden? Amerikaanse verdeeldheid over herten in de voorsteden  Hoe lang zou het duren om Auckland te ontvluchten als een vulkaan op het punt stond uit te barsten?
Hoe lang zou het duren om Auckland te ontvluchten als een vulkaan op het punt stond uit te barsten?
Hoofdlijnen
- Onderzoekers ontdekken een mechanisme dat de kiemrust in boompioenen reguleert
- Waarom zijn er geen huismussen zo groot als ganzen?
- Wat heeft een mutatie te maken met menselijk DNA?
- Twee vormen van de eigenschappen zaadvorm in erwtenplanten zijn?
- Onderzoekers identificeren hoe koninginnen de vruchtbaarheid van werknemers onderdrukken
- Zien is geloven:observatie van migrasomen
- Hoe creoolse talen evolueren, kan afhangen van hoe mensen ze begonnen te gebruiken
- Wat betekent kwantitatief in de wetenschap?
- Wat is het forumla voor fotosynthese?
- Materiaal en coatingproces om keramische onderdelen te beschermen
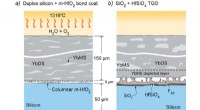
- Betere omzetting van biomassa voor biobrandstoffen en bioproducten

- De universele waarheid over plakkerige oppervlakken

- Nieuwe techniek kan gevangen koolstof waardevoller maken

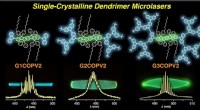
- Dendrimers hebben eindelijk wat nodig is om door te breken in de laserscene
 Nieuwe etiketteringsaanpak maakt onderzoek van verzonden pakketjes mogelijk om inzicht te krijgen in gezondheid
Nieuwe etiketteringsaanpak maakt onderzoek van verzonden pakketjes mogelijk om inzicht te krijgen in gezondheid Leven op een luchtloze aarde
Leven op een luchtloze aarde Waarom hebben bodems verschillende kleuren?
Waarom hebben bodems verschillende kleuren?  Science Fair-projecten met kalksteen Popcorn-kristallen
Science Fair-projecten met kalksteen Popcorn-kristallen  Chloraatrijke grond kan ons helpen vloeibaar water op Mars te vinden
Chloraatrijke grond kan ons helpen vloeibaar water op Mars te vinden Studie onderzoekt hoe klimaatverandering de regen in de Amerikaanse Corn Belt kan beïnvloeden
Studie onderzoekt hoe klimaatverandering de regen in de Amerikaanse Corn Belt kan beïnvloeden  Identificatie van een complex groeiproces van dunne films van strontiumtitanaat
Identificatie van een complex groeiproces van dunne films van strontiumtitanaat Hoe ontvangt de aarde warmte van de zon?
Hoe ontvangt de aarde warmte van de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

