
Wetenschap
Wat zijn Polar Mole Cules?
Polaire moleculen:een gedetailleerde uitleg
Een polair molecuul is een molecuul dat een positief en een negatief einde heeft , wat betekent dat het een dipoolmoment heeft . Dit gebeurt vanwege het ongelijke delen van elektronen tussen atomen in het molecuul.
Hier is een uitsplitsing:
1. Elektronen en polariteit:
* elektronegativiteit: Elk element heeft een ander vermogen om elektronen aan te trekken in een chemische binding. Dit vermogen wordt elektronegativiteit genoemd.
* ongelijke delen: Wanneer atomen met verschillende elektronegativiteiten binden, trekt het meer elektronegatief atoom de gedeelde elektronen dichter bij zichzelf. Dit creëert een lichte negatieve lading op dat atoom en een lichte positieve lading op het minder elektronegatieve atoom.
2. Dipolen:
* Dipoolmoment: De scheiding van ladingen binnen een molecuul creëert een dipoolmoment, wat een vectorhoeveelheid is met zowel grootte als richting.
* Polaire moleculen: Moleculen met een significant dipoolmoment worden beschouwd als polaire moleculen.
3. Vormen doen ertoe:
* Moleculaire geometrie: De vorm van een molecuul beïnvloedt zijn polariteit. Een symmetrisch molecuul zoals koolstofdioxide (CO2) is bijvoorbeeld niet-polair, hoewel de koolstofoxygenbindingen polair zijn. Dit komt omdat de twee dipolen elkaar opzeggen vanwege de lineaire vorm.
* asymmetrische moleculen: Moleculen met asymmetrische vormen, zoals water (H2O), zijn meestal polair. De gebogen vorm voorkomt dat de dipolen worden geannuleerd.
4. Voorbeelden van polaire moleculen:
* Water (H2O)
* Ethanol (C2H5OH)
* Ammoniak (NH3)
* Waterstofchloride (HCl)
5. Belang van polariteit:
* Oplosbaarheid: Polaire moleculen hebben de neiging om op te lossen in polaire oplosmiddelen (zoals water) omdat de positieve en negatieve uiteinden van de moleculen kunnen interageren door waterstofbinding of dipool-dipoolinteracties.
* kookpunt: Polaire moleculen hebben hogere kookpunten dan niet-polaire moleculen omdat de dipool-dipoolinteracties meer energie vereisen om te overwinnen.
* Biologische betekenis: Polariteit speelt een cruciale rol in biologische processen zoals celmembranen en eiwitvouwing.
Samenvattend worden polaire moleculen gekenmerkt door ongelijke delen van elektronen, wat resulteert in een scheiding van lading en een dipoolmoment. Deze eigenschap heeft belangrijke implicaties voor oplosbaarheid, kookpunten en biologische functies.
 Waar zijn in het periodiek systeem met metalen elementen gevonden?
Waar zijn in het periodiek systeem met metalen elementen gevonden?  Wat is een atoom met meer of minder neutronen dan atomen van hetzelfde element?
Wat is een atoom met meer of minder neutronen dan atomen van hetzelfde element?  Gecontroleerde afgifte van kunstmest met behulp van biopolymeerchips
Gecontroleerde afgifte van kunstmest met behulp van biopolymeerchips Eén reden dat water een effectief oplosmiddel is?
Eén reden dat water een effectief oplosmiddel is?  Hoe reageert zure regen op gebouwen en standbeelden?
Hoe reageert zure regen op gebouwen en standbeelden?
Hoofdlijnen
- Wie zijn de meest populaire wetenschapper?
- Ongevaarlijk of dodelijk? Onderzoek naar de evolutie van E. coli
- Wat is Ashwagandha?
- Wat zijn B -cellen plasma en antilichamen een deel van?
- Polymeren zijn veelbelovend voor genafgifte, weefselsteigers en andere biomedische toepassingen
- Een probioticum voor onze longen? Nieuw onderzoek roept vragen op over de toekomst van de behandeling van COVID-19
- Waarom wordt informatie opgeslagen in DNA-bewijsmateriaal vóór een schepper en tegen de evolutie?
- Is rijst een voorbeeld van epigeale kieming?
- Wat zijn alle labeldelen van chromosoom?
- Sneller en groener zuiveringsproces met kooldioxide

- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
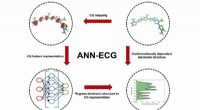
- Versnelde ontdekkingssnelheid kan leiden tot effectievere hulpmiddelen om te stoppen met roken
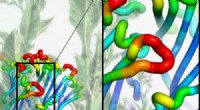
- Virushydrofobiciteit kan helpen bij het zuiveren van vaccins
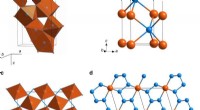
- Nieuwe benadering van moleculaire modellering kan de ontwikkeling van nieuwe organische materialen voor elektronica versnellen
 Wat betekent dropzone?
Wat betekent dropzone?  Hoeveel Topaz -rotsen zijn er ter wereld?
Hoeveel Topaz -rotsen zijn er ter wereld?  Hoe is de diepte en breedte van Great Rift Valley verhouden tot Grand Canyon?
Hoe is de diepte en breedte van Great Rift Valley verhouden tot Grand Canyon?  Nieuwe tool bepaalt bedreigingen voor 3D-printers in een netwerk
Nieuwe tool bepaalt bedreigingen voor 3D-printers in een netwerk Wetenschappers tonen aan dat het oude dorp zich heeft aangepast aan droogte en stijgende zeeën
Wetenschappers tonen aan dat het oude dorp zich heeft aangepast aan droogte en stijgende zeeën  Vrouw gedood door rondvliegend puin terwijl storm Doris Groot-Brittannië teistert
Vrouw gedood door rondvliegend puin terwijl storm Doris Groot-Brittannië teistert Waarom hebben we geen elektrische vliegtuigen?
Waarom hebben we geen elektrische vliegtuigen? Virusgenomen helpen verklaren waarom een belangrijke veeziekte opnieuw de kop opsteekt in Europa
Virusgenomen helpen verklaren waarom een belangrijke veeziekte opnieuw de kop opsteekt in Europa
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

