
Wetenschap
Waarom staat water bekend als Universal Solvent?
1. Polariteit:
* Watermoleculen zijn polair: Ze hebben een enigszins positief uiteinde (nabij de waterstofatomen) en een enigszins negatief uiteinde (nabij het zuurstofatoom). Met deze polariteit kan water interageren met zowel positieve als negatief geladen ionen en moleculen.
2. Waterstofbinding:
* Sterke waterstofbruggen: Watermoleculen vormen sterke waterstofbruggen met elkaar en met andere polaire moleculen. Hierdoor kan water de bindingen uit elkaar trekken die ionische verbindingen bij elkaar houden en oplost.
3. Hoge diëlektrische constante:
* Water's hoge diëlektrische constante: Water verzwakt de elektrostatische krachten tussen ionen, waardoor het voor hen gemakkelijker kan worden gescheiden en oplost.
4. Cohesie en hechting:
* samenhangende en lijmeigenschappen: Watermoleculen worden tot elkaar aangetrokken (cohesie) en tot andere stoffen (hechting). Met deze eigenschappen kan water spaties doordringen en interageren met moleculen.
Voorbeelden van de solvabiliteit van het water:
* zout (NaCl): Water lost zout op door de natrium- en chloride -ionen te omringen met zijn polaire moleculen en ze uit elkaar te trekken.
* Sugar (C12H22O11): Water lost suiker op door waterstofbindingen te vormen met de suikermoleculen, waardoor de bindingen binnen de suikerstructuur worden verzwakt.
* Zuurstof en koolstofdioxide: Hoewel minder oplosbaar, zijn deze gassen nog steeds opgelost in water, cruciaal voor het waterleven.
Belangrijke opmerking: Niet alles lost op in water. Stoffen zoals vetten en oliën zijn niet -polair en lossen niet gemakkelijk op in water.
Samenvattend: Water unieke eigenschappen van polariteit, waterstofbinding, hoge diëlektrische constante en samenhangende/lijmkrachten maken het een krachtig oplosmiddel voor een breed scala aan stoffen, waardoor het de titel van "Universal Solvent" verdient.
Hoofdlijnen
- Zorgt de recycling van ATP voor voortzetting glycolyse onder anaërobe omstandigheden?
- Waarom kunstmatige intelligentie de gezondheidszorg nog niet heeft gerevolutioneerd
- Waarom groeit de groei vanuit het midden van het lichaam naar buiten?
- Geef de fasen in het proces van bevruchtingszoogdieren?
- Hoe kan een mutatie in DNA de eiwitsynthese beïnvloeden?
- Mechanische eigenschappen van stamcellen kunnen voorspellen wat ze zullen worden
- Hoe bioarcheologie werkt
- Als ribosomen botsen:hoe bacteriën opruimen na moleculaire crashes
- Een parasiet volgen die vissen verwoest
- Robotachtige zachte materie buigt, draait en kruipt wanneer geraakt met licht

- Hoe metaalatomen zich kunnen rangschikken op een isolator

- Nieuw, gladde toiletcoating zorgt voor schoner doorspoelen, bespaart water

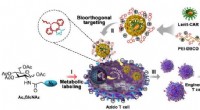
- Wetenschappers ontwikkelen kunstmatige chemische receptor om virale transductie voor T-cel-engineering te ondersteunen
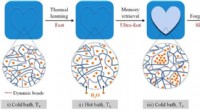
- Hydrogel bootst het menselijk brein na met het vermogen om te onthouden en te vergeten
 Waar kan calcium geografisch gezien op aarde worden gevonden?
Waar kan calcium geografisch gezien op aarde worden gevonden?  Lang gezochte eiwitstructuur kan helpen onthullen hoe 'genenschakelaar' werkt (video)
Lang gezochte eiwitstructuur kan helpen onthullen hoe 'genenschakelaar' werkt (video)  Onderzoekers vinden schadelijke ijswolk op Saturnusmaan Titan
Onderzoekers vinden schadelijke ijswolk op Saturnusmaan Titan Grote vulkaanuitbarsting in Schotland heeft mogelijk bijgedragen aan de prehistorische opwarming van de aarde
Grote vulkaanuitbarsting in Schotland heeft mogelijk bijgedragen aan de prehistorische opwarming van de aarde Verbeterde eiwitanalyse kan vroege ziektedetectie helpen
Verbeterde eiwitanalyse kan vroege ziektedetectie helpen Studie biedt oordeel voor China's inspanningen op het gebied van kolenemissies
Studie biedt oordeel voor China's inspanningen op het gebied van kolenemissies Satelliet vindt windschering die tropische storm Lowell . beïnvloedt
Satelliet vindt windschering die tropische storm Lowell . beïnvloedt Bestuderen van argongas gevangen in een tweedimensionale reeks kleine kooien
Bestuderen van argongas gevangen in een tweedimensionale reeks kleine kooien
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


