
Wetenschap
Hoe pyrimidine wordt basic?
Dit is waarom:
* Lone Pair -elektronen: De stikstofatomen in pyrimidine hebben een eenzaam paar elektronen. Deze elektronen zijn beschikbaar om een proton (H+) uit een zuur te accepteren.
* Resonantiestabilisatie: Wanneer pyrimidine een proton accepteert, kan de positieve lading door resonantie rond de ring worden gedelokaliseerd. Deze resonantie -stabilisatie verhoogt de stabiliteit van de geprotoneerde pyrimidine, waardoor het waarschijnlijker is.
* Zwakke basis: Pyrimidine is een zwakke basis omdat het alleen protonen met matig gemak accepteert. Het heeft een relatief hoge PKA -waarde (ongeveer 1,3), wat betekent dat het minder waarschijnlijk wordt geprotoneerd in neutrale oplossingen.
In tegenstelling tot pyrimidine, zijn de derivaten zoals cytosine, thymine en uracil meer fundamenteel vanwege de aanwezigheid van aminogroepen (-NH2) die veel betere protonenacceptoren zijn.
Samenvattend:
* Pyrimidine zelf is niet eenvoudig, maar het kan als een zwakke basis werken vanwege zijn stikstofatomen en resonantiestabilisatie.
* Pyrimidinederivaten zoals cytosine, thymine en uracil zijn fundamenteeler vanwege hun aminogroepen.
Hier is een analogie:
Stel je pyrimidine voor als een spons die een kleine hoeveelheid water (protonen) kan absorberen. Hoewel het wat water kan absorberen, geniet het niet snel of gemakkelijk als een zeer absorberende handdoek. Dit is vergelijkbaar met hoe pyrimidine een zwakke basis is - het kan protonen accepteren, maar het doet dit niet zo snel als sterkere basen.
 Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen
Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen  Wat is de chemische reactie van mg plus cu so4?
Wat is de chemische reactie van mg plus cu so4?  Is scheikunde een harde wetenschap of zachte wetenschap?
Is scheikunde een harde wetenschap of zachte wetenschap?  Hebben verbindingen een bepaalde samenstelling?
Hebben verbindingen een bepaalde samenstelling?  Wetenschappers ontwikkelen een effectieve aanpak voor het optimaliseren van medicinale moleculen
Wetenschappers ontwikkelen een effectieve aanpak voor het optimaliseren van medicinale moleculen
 Indonesië geeft tsunamiwaarschuwing na aardbeving Molukse Zee
Indonesië geeft tsunamiwaarschuwing na aardbeving Molukse Zee NASA-satelliet vindt Jongdari een tropische depressie
NASA-satelliet vindt Jongdari een tropische depressie Difference Between Mosquito & Sand Fly Bites
Difference Between Mosquito & Sand Fly Bites  Wetenschappers verlagen waarschuwingsniveau voor Hawaii-vulkaan
Wetenschappers verlagen waarschuwingsniveau voor Hawaii-vulkaan Rusland worstelt met het opruimen van gemorste brandstof in de Arctische rivier
Rusland worstelt met het opruimen van gemorste brandstof in de Arctische rivier
Hoofdlijnen
- Forest Service weegt wijzigingen in bescherming voor saliehoen af
- Wat veroorzaakt DNA-mutatie?
- Verspreiden bacteriën en virus zich op dezelfde manier?
- Tussen geometrie en biologie:hoe waarom is het aantal soorten afhankelijk van het gebied?
- Top 10 ziektekiemen op uw smartphone
- Wat is osmose actief of passief?
- Voeden volwassen periodieke cicaden zich eigenlijk met iets?
- Wat is alumanodi?
- Zo'n 230 walvissen gestrand in Tasmanië; reddingspogingen aan de gang
- De eerste cellen zijn mogelijk ontstaan omdat bouwstenen van eiwitten membranen stabiliseerden
- Machine learning versnelt de ontwikkeling en implementatie van hoogwaardige materialen

- Wetenschappers verduidelijken aspect van interacties tussen vaste stoffen en vloeistoffen in dunne film

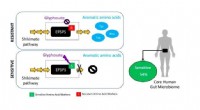
- Glyfosaat kan de menselijke darmflora beïnvloeden
- Materiaal met één elektrode stroomlijnt functies tot een kleine chip

 Gefluister van de donkere kant:wat kunnen zwaartekrachtsgolven onthullen over donkere materie?
Gefluister van de donkere kant:wat kunnen zwaartekrachtsgolven onthullen over donkere materie? De geheimen van de zon onthullen:hoe magnetische structuren coronale rotatie aandrijven
De geheimen van de zon onthullen:hoe magnetische structuren coronale rotatie aandrijven  Veeteelt:een antwoord op het verbranden van gewasresten
Veeteelt:een antwoord op het verbranden van gewasresten Voyager 2 ontdekte nieuwe manen en ringen om me heen in 1989?
Voyager 2 ontdekte nieuwe manen en ringen om me heen in 1989?  Marsrover komt leeg in 1e poging om rockmonster te krijgen
Marsrover komt leeg in 1e poging om rockmonster te krijgen Materialen op bestelling:ingenieurs richten zich op de nano om sterke, lichtgewicht materialen
Materialen op bestelling:ingenieurs richten zich op de nano om sterke, lichtgewicht materialen GM, Fiat Chrysler rapporteert lagere autoverkopen in de VS door virushit
GM, Fiat Chrysler rapporteert lagere autoverkopen in de VS door virushit Chileense dennenbossen:een botanische dinosaurus met uitsterven bedreigd?
Chileense dennenbossen:een botanische dinosaurus met uitsterven bedreigd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

