
Wetenschap
Wat wordt bedoeld met een hydrofoob aminozuur?
Dit is waarom dit belangrijk is:
* Eiwitvouwen: Hydrofobe aminozuren spelen een cruciale rol bij het vouwen van eiwitten. Ze hebben de neiging om samen te clusteren in het interieur van het eiwit, weg van de waterige omgeving rondom de cel. Dit creëert een stabiele, hydrofobe kern die het eiwit helpt zijn vorm te behouden.
* Eiwitfunctie: Hydrofobe interacties zijn ook belangrijk voor eiwit-eiwit interacties en de binding van liganden (moleculen die binden aan eiwitten). Hydrofobe aminozuren in de actieve plaats van een enzym kunnen bijvoorbeeld helpen bij het binden van een hydrofoob substraat.
Voorbeelden van hydrofobe aminozuren:
* Alanine (Ala, A)
* valine (val, v)
* leucine (Leu, L)
* isoleucine (ile, i)
* methionine (Met, M)
* fenylalanine (phe, f)
* tryptophan (trp, w)
* proline (pro, p)
Wat maakt deze aminozuren hydrofoob?
* Niet -polaire zijketens: Ze hebben zijketens die meestal op koolwaterstof zijn gebaseerd (met koolstof- en waterstofatomen). Deze zijketens worden niet aangetrokken door watermoleculen, die polair zijn.
* Hydrofobe interacties: Hydrofobe aminozuren hebben de neiging om met elkaar te interageren door zwakke, niet-covalente krachten die hydrofobe interacties worden genoemd. Deze interacties helpen bij het stimuleren van het vouwen en monteren van eiwitten.
In tegenstelling tot hydrofobe aminozuren, hydrofiele aminozuren worden aangetrokken door water en worden meestal aangetroffen op het oppervlak van eiwitten, waar ze kunnen interageren met de omringende waterige omgeving.
 Corbin komt vóór stikstof op het periodiek systeem vanwege koolstof?
Corbin komt vóór stikstof op het periodiek systeem vanwege koolstof?  Apparaatupdate maakt mobiel testen op virussen mogelijk, bacteriën en actieve toxines
Apparaatupdate maakt mobiel testen op virussen mogelijk, bacteriën en actieve toxines Technologie versnelt het proces om salmonella te detecteren, E coli, andere door voedsel overgedragen ziekten
Technologie versnelt het proces om salmonella te detecteren, E coli, andere door voedsel overgedragen ziekten Zweten is endotherm of exotherm?
Zweten is endotherm of exotherm?  Studie onthult details over hoe een veelgebruikte katalysator water splitst
Studie onthult details over hoe een veelgebruikte katalysator water splitst
 Nationaal afval:vermindering van afval geproduceerd in nationale parken in de VS
Nationaal afval:vermindering van afval geproduceerd in nationale parken in de VS Grond- en satellietobservaties brengen schade aan gebouwen in kaart na de explosie in Beiroet
Grond- en satellietobservaties brengen schade aan gebouwen in kaart na de explosie in Beiroet Het Tijuana-riool sluit de kustlijnen van Imperial Beach en Coronado opnieuw af
Het Tijuana-riool sluit de kustlijnen van Imperial Beach en Coronado opnieuw af Erosie-instabiliteiten op landschapsschaal in het noorden van Gabilan Mesa, Californië
Erosie-instabiliteiten op landschapsschaal in het noorden van Gabilan Mesa, Californië Hoeveel regen is er in een typische orkaan?
Hoeveel regen is er in een typische orkaan?
Hoofdlijnen
- Wat is het thuisbox-gen?
- RNA is misschien niet het eerste erfelijke systeem geweest dat zich ontwikkelt?
- De voordelen van de bestrijding van doornenkroon op het Great Barrier Reef
- Hoe onderzoekers naar het vogelbrein in actie kijken
- Planten kunnen worden gebruikt om te bestuderen hoe en waarom mensen verschillend reageren op medicijnen
- Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
- Wat is kwantitave onherkenning in het genen?
- Wat is de medische term die niet betekent dat niet -ranselcel niet is?
- Nieuwe studie onderzoekt ATP-synthase in zure toestand om te onthullen hoe het enzym functioneert
- Fotokatalytische waterstofproductie uit water
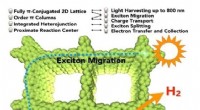
- LED's maken de weg vrij voor betere medicamenteuze therapieën

- Nieuwe niet-destructieve optische techniek onthult de structuur van parelmoer

- Wetenschappers ontrafelen het mysterie van hoe straling metaal verzwakt, één atoom tegelijk

- Het onzichtbare spotten
 Elektrische verbetering:ingenieurs versnellen elektronen in halfgeleiders
Elektrische verbetering:ingenieurs versnellen elektronen in halfgeleiders Duitse auto-industrie waarschuwt CO2-doelen riskante banen
Duitse auto-industrie waarschuwt CO2-doelen riskante banen Onderzoekers geven nieuwe aanwijzing voor het probleem van de coronale verwarming van de zon
Onderzoekers geven nieuwe aanwijzing voor het probleem van de coronale verwarming van de zon Hoe reproduceert een eekhoorn?
Hoe reproduceert een eekhoorn?  Het mysterie openbreken hoeveel bubbels er in een glas bier zitten
Het mysterie openbreken hoeveel bubbels er in een glas bier zitten Wat waren Charles -prestaties aan de wetenschap?
Wat waren Charles -prestaties aan de wetenschap?  Vier nieuwe korte-periode reuzenplaneten ontdekt
Vier nieuwe korte-periode reuzenplaneten ontdekt Nanotechnologie en zonlicht maken de weg vrij voor een betere zichtbaarheid
Nanotechnologie en zonlicht maken de weg vrij voor een betere zichtbaarheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

