
Wetenschap
Hoe blijven de koperatomen in een cent bij elkaar?
1. Elektronen in de buitenste schaal: Koperatomen hebben elektronen in hun buitenste schaal, die losjes worden vastgehouden.
2. Zee van elektronen: Wanneer koperatomen samenkomen om een vaste stof te vormen, worden deze buitenste elektronen gedelocaliseerd. Dit betekent dat ze niet gebonden zijn aan een bepaald atoom, maar eerder vrij door de hele structuur bewegen. Dit creëert een "zee van elektronen".
3. Attractie: De positief geladen koperkernen worden nu aangetrokken tot deze negatief geladen zee van elektronen. Deze elektrostatische aantrekkingskracht is wat de koperatomen bij elkaar houden in een sterke, metalen binding.
Belangrijke kenmerken van metalen binding:
* sterk: Metaalbindingen zijn erg sterk, en daarom zijn metalen over het algemeen moeilijk en hebben ze hoge smeltpunten.
* geleidbaarheid: Met de vrij bewegende elektronen kunnen metalen elektriciteit leiden en zeer goed verwarmen.
* kneedbaarheid en ductiliteit: Het vermogen van metalen om te vormen (kneedbaarheid) of getrokken draden (ductiliteit) komt voort uit de flexibiliteit van de metalen binding. De elektronen kunnen hun posities gemakkelijk aanpassen als de atomen worden herschikt.
Kortom, de zee van elektronen in een cent werkt als lijm, die de koperatomen in een sterke en stabiele structuur houdt.
 Duurzaam waterzuiveringssysteem geïnspireerd door de natuur
Duurzaam waterzuiveringssysteem geïnspireerd door de natuur Van atoom tot natural killer cel:het verhaal van een onverwachte eiwitstructuur
Van atoom tot natural killer cel:het verhaal van een onverwachte eiwitstructuur Lijst met geleiders
Lijst met geleiders  Enkele moleculen vastgelegd op video met een ongekende 1, 600 beelden per seconde
Enkele moleculen vastgelegd op video met een ongekende 1, 600 beelden per seconde Zelf-uitgezonden oppervlaktegolfingen in dynamische breuk van silicium eenkristal
Zelf-uitgezonden oppervlaktegolfingen in dynamische breuk van silicium eenkristal
 Zorgprofessionals zijn belangrijke communicatoren bij het aanpakken van klimaatverandering
Zorgprofessionals zijn belangrijke communicatoren bij het aanpakken van klimaatverandering Verspreiding en oorsprong van zeer radioactieve microdeeltjes in Fukushima onthuld
Verspreiding en oorsprong van zeer radioactieve microdeeltjes in Fukushima onthuld Schimmelbesmetting in zeezout kan voedsel mogelijk bederven
Schimmelbesmetting in zeezout kan voedsel mogelijk bederven Deken van rotspuin biedt gletsjers meer bescherming tegen klimaatverandering dan eerder bekend
Deken van rotspuin biedt gletsjers meer bescherming tegen klimaatverandering dan eerder bekend Onderzoekers detecteren broomatomen in het noordpoolgebied in de lente
Onderzoekers detecteren broomatomen in het noordpoolgebied in de lente
Hoofdlijnen
- Wat zijn 5 voorbeelden van vaatplanten?
- De effecten van temperatuur op enzymactiviteit en biologie
- Waar handelt Amylase bij mensen?
- Nieuwe studie ontdekt hoe veranderde eiwitvouwing de meercellige evolutie aandrijft
- Hoeveel chromosomen zijn er in cellen van het menselijk lichaam?
- Sterfgevallen chimpansees in Oeganda toegeschreven aan menselijk verkoudheidsvirus
- Onderzoekers volgen hoe sporen uit de slapende toestand ontsnappen
- Meloenen moleculair pantser:nieuwe inzichten in gewasbescherming
- Hoe zijn eten en ademen gerelateerd aan cellulaire ademhaling?
- Onderzoekers ontdekken chemische reactie die een verrassend molecuul gebruikt

- Een manier om tegen lage kosten schonere metaalvrije perovskieten te maken
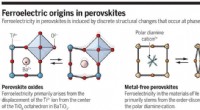
- Een grote stap voorwaarts in organische elektronica

- Nieuwe inzichten in bacteriële toxines
- Schone technologie om chitosan met laag molecuulgewicht te maken

 Welke vier dingen maken ribosomen anders dan organellen?
Welke vier dingen maken ribosomen anders dan organellen?  Wat regelt de gloeilamp en warmte in een incubator?
Wat regelt de gloeilamp en warmte in een incubator?  Welk type elektromagnetische straling heeft de grootste frequentie en de laagste golflengte?
Welk type elektromagnetische straling heeft de grootste frequentie en de laagste golflengte?  Wat is het verschil tussen absolute magnitude en helderheid in termen van het meten van de helderheid van hemellichamen?
Wat is het verschil tussen absolute magnitude en helderheid in termen van het meten van de helderheid van hemellichamen?  Onderzoek toont de rol van inheemse rentmeesterschappen in de veerkracht van bosecosystemen aan
Onderzoek toont de rol van inheemse rentmeesterschappen in de veerkracht van bosecosystemen aan  Euraziatische anomalieën in de atmosferische circulatie kunnen van de winter tot de volgende lente aanhouden
Euraziatische anomalieën in de atmosferische circulatie kunnen van de winter tot de volgende lente aanhouden Nieuwe methode maakt bio-ethanol uit afval in bestaande installaties
Nieuwe methode maakt bio-ethanol uit afval in bestaande installaties Exoplaneten
Exoplaneten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

