
Wetenschap
Wat is de enthalpie van een reactie?
Hier is een uitsplitsing:
* exotherme reactie: ΔH is negatief , wat betekent dat warmte is vrijgegeven in de omgeving. De reactie voelt heet . Voorbeelden zijn verbrandings- en neutralisatiereacties.
* Endotherme reactie: ΔH is positief , wat betekent dat warmte geabsorbeerd is uit de omgeving. De reactie voelt koud . Voorbeelden zijn smeltenijs en fotosynthese.
Sleutelpunten:
* Enthalpy Change (ΔH) is een statusfunctie , wat betekent dat het alleen afhangt van de initiële en uiteindelijke toestanden van het systeem, niet op het genomen pad.
* De enthalpie van een reactie wordt meestal gemeten in kilojoules per mol (kj/mol) .
* Het is belangrijk op te merken dat enthalpieverandering een theoretisch concept is en meet niet direct de warmte die wordt uitgewisseld in een real-world reactie. Factoren zoals warmteverlies voor de omgeving kunnen de werkelijke warmteverandering beïnvloeden.
Toepassingen:
* Voorspelling van de haalbaarheid van een reactie: Een negatieve AH suggereert dat een reactie waarschijnlijk spontaan zal optreden.
* het ontwerpen en optimaliseren van chemische processen: Inzicht in enthalpie -veranderingen zorgt voor het ontwerpen van reacties met gewenste hitte -effecten.
* Bereken van energievereisten voor chemische processen: Kennis van enthalpiewijzigingen helpt de energie te bepalen die nodig is voor specifieke reacties.
Samenvattend: De enthalpie van een reactie is een belangrijke thermodynamische eigenschap die de geabsorbeerde warmte kwantificeert of vrijkomt tijdens een chemische transformatie, waardoor waardevolle inzichten worden geboden in de betrokken energieveranderingen.
 Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas
Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas Klein worden om te bepalen waar nucleair materiaal vandaan komt en hoe het is gemaakt
Klein worden om te bepalen waar nucleair materiaal vandaan komt en hoe het is gemaakt Geactiveerde kool
Geactiveerde kool Meertraps vervormingsproces in legeringen met hoge entropie bij ultralage temperaturen onthuld
Meertraps vervormingsproces in legeringen met hoge entropie bij ultralage temperaturen onthuld 54 Koolstofatomen Hoeveel kunnen deel uitmaken van glucose?
54 Koolstofatomen Hoeveel kunnen deel uitmaken van glucose?
 Versnelde uitspoeling van radiocesium uit strooisel op de bosbodem door hevige regenval
Versnelde uitspoeling van radiocesium uit strooisel op de bosbodem door hevige regenval Grote meteorietinslagen zorgden voor plaattektonische processen op de vroege aarde
Grote meteorietinslagen zorgden voor plaattektonische processen op de vroege aarde Onvruchtbare slakken zijn hersteld langs de Noorse kust
Onvruchtbare slakken zijn hersteld langs de Noorse kust IJsverlies door opwarming leidt tot opwarming door ijsverlies:Een vicieuze cirkel
IJsverlies door opwarming leidt tot opwarming door ijsverlies:Een vicieuze cirkel Hoe het klimaat de kustwateren van de Golf van Exmouth beïnvloedt
Hoe het klimaat de kustwateren van de Golf van Exmouth beïnvloedt
Hoofdlijnen
- Bacterieel 'schakelgen' reguleert hoe oceanen zwavel in de atmosfeer uitstoten
- Spechten vertonen tekenen van mogelijke hersenbeschadiging, maar dat is misschien geen slechte zaak
- Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
- Wat gebeurt er met het nucleolus en nucleair membraan tijdens celdeling?
- organen? - Antwoorden
- Vroege detectiesysteem voor hinderlijke algenplagende Papahānaumokuākea-riffen
- Wat zou er met een cel gebeuren als DNA niet werd gevouwen?
- Onderzoek zou de weg kunnen vrijmaken voor een beter begrip van de manier waarop planten en dieren groeien en zich ontwikkelen
- Wat maakt bacteriën leven?
- Wetenschappers observeren hoe potentiële kankerbehandeling reageert in een enkele cel
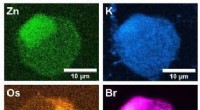
- Een koolstofvrije wereld katalyseren door energie uit levende cellen te halen
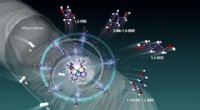
- Onderzoekers ontdekken verborgen SARS-CoV-2-poort die opengaat om COVID-infectie mogelijk te maken

- Kleine borstels die oppervlakken glad maken, werken mogelijk niet zoals bedoeld, studie vondsten

- Een zoete oplossing nabootsen om vervuiling op te ruimen
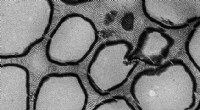
 Nieuwe wiskundige hulpmiddelen om opiniedynamiek te bestuderen
Nieuwe wiskundige hulpmiddelen om opiniedynamiek te bestuderen Binnenlands kust- en zeetoerisme kan bijdragen aan het opnieuw opstarten van de activiteit in de sector
Binnenlands kust- en zeetoerisme kan bijdragen aan het opnieuw opstarten van de activiteit in de sector Hoe koolstofbelasting werkt
Hoe koolstofbelasting werkt  Nieuwe katalysator realiseert ongekende activiteiten
Nieuwe katalysator realiseert ongekende activiteiten Wat is nuttige en verspilde energie?
Wat is nuttige en verspilde energie?  Welke stoffen kunnen elektriciteit in vaste toestand leiden?
Welke stoffen kunnen elektriciteit in vaste toestand leiden?  Wat zijn de voedselproductiestructuren van een plantencel?
Wat zijn de voedselproductiestructuren van een plantencel?  Een superlichtgevende supernova van een massieve voorouderster
Een superlichtgevende supernova van een massieve voorouderster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

