
Wetenschap
Waarom laten zout en suiker ijs smelten?
* Freezing Point Depression: Water bevriest bij 32 ° F (0 ° C). Wanneer u zout of suiker toevoegt, verstoort dit het vermogen van de watermoleculen om de kristalstructuur te vormen die nodig is om te bevriezen. Dit verlaagt effectief de temperatuur waarbij water zal bevriezen.
* zout: Zout lost op in water en vormt ionen (geladen deeltjes). Deze ionen staan de watermoleculen in de weg, waardoor het voor hen moeilijker is om zich te verbinden en te bevriezen.
* Sugar: Suiker lost ook op in water, maar in plaats van ionen vormt het een "suikeroplossing". Deze oplossing heeft een lager vriespunt dan zuiver water omdat de suikermoleculen het vermogen van het watermolecuul om ijskristallen te vormen verstoren.
Waarom is dit nuttig?
* de-icing: Zout wordt vaak gebruikt om ijs op wegen en trottoirs te smelten omdat het het vriespunt van water onder de typische omgevingstemperatuur verlaagt, waardoor het voor het ijs gemakkelijker wordt om te smelten.
* Voedselbehoud: Suiker wordt gebruikt in jam en gelei om bevriezing te voorkomen. De hoge suikerconcentratie verlaagt het vriespunt van het mengsel.
Belangrijke opmerking: Hoewel zowel zout als suiker het vriespunt van water verlagen, is zout veel effectiever dan suiker vanwege de aanwezigheid van ionen.
Hoofdlijnen
- Wat is de betekenis van bio-intensief?
- Waarom hebben jullie botcellen en rood bloed minder mitochondriën?
- Hoe isoleer je een beker water?
- Waarom wordt evolutie als theorie overgebracht?
- Een model dat bekend staat als een wat gebruikt DNA -vergelijkingen om te schatten de tijdsduur die soorten onafhankelijk zijn geëvolueerd?
- Hoe wolvenpersoonlijkheden wetlands kunnen veranderen
- Wat is de relatie tussen het anabolisme -metabolisme en het katabolisme?
- Philadelphia Zoo euthanaseert populaire Aziatische zwarte beer
- Wat is de functie van de huidmondjescel?
- Nog een stap in de richting van synthetische cellen
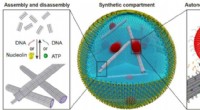
- Ultrasnelle compressie biedt nieuwe manier om macromoleculen in cellen te krijgen

- Door licht geactiveerde metaalkatalysator vernietigt vitale energiebron van kankercellen

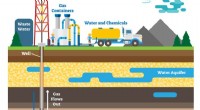
- Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt
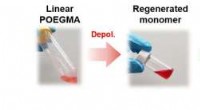
- Plastic afbreken in zijn samenstellende delen
 Wat is een ozon -gootsteen?
Wat is een ozon -gootsteen?  Waarom ammoniaksymmetrisch?
Waarom ammoniaksymmetrisch?  Molfracties berekenen met massapercentage
Molfracties berekenen met massapercentage  Hoe de huidige capaciteit van transformatoren te bepalen
Hoe de huidige capaciteit van transformatoren te bepalen Onderzoekers bepalen de beste locaties voor camera's
Onderzoekers bepalen de beste locaties voor camera's Stuur je naam naar de zon aan boord van NASA's Parker Solar Probe
Stuur je naam naar de zon aan boord van NASA's Parker Solar Probe Denkt u dat een benzinemotor met directe injectie de groene keuze is? Misschien niet
Denkt u dat een benzinemotor met directe injectie de groene keuze is? Misschien niet  Hoe laag strekt de biosfeer zich uit?
Hoe laag strekt de biosfeer zich uit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


