
Wetenschap
Als een atoom een stabiel aantal elektronen heeft, hoe kun je dat dan weten?
Rangschikking van elektronen in energieniveaus:
- Een stabiel atoom heeft een volledige en stabiele rangschikking van elektronen in zijn energieniveaus.
- De laagste energieniveaus (binnenste schillen) worden gevuld voordat elektronen hogere energieniveaus bezetten (buitenste schillen).
- De buitenste elektronenschil, bekend als de valentieschil, speelt een cruciale rol bij het bepalen van de stabiliteit en het chemische gedrag van een atoom.
Elektronenconfiguratie en edelgasconfiguratie:
- Atomen met een edelgasconfiguratie worden als het meest stabiel beschouwd. Edelgassen hebben een volledige buitenste elektronenschil, waardoor ze een stabiel en niet-reactief karakter hebben.
- Elementen uit groep 1 (alkalimetalen) en groep 17 (halogenen) zijn zeer reactief omdat ze respectievelijk één elektron meer of één elektron minder hebben dan een edelgasconfiguratie.
Octetregel en valentie-elektronen:
- De octetregel stelt dat atomen de neiging hebben elektronen te winnen, te verliezen of te delen om een stabiele configuratie van acht elektronen op het buitenste energieniveau te bereiken.
- Elementen in de tweede periode (rij) van het periodiek systeem (behalve helium) volgen de octetregel door hun valentie-elektronen te delen om hun valentieschil te voltooien.
- Atomen met een volledige octetschil, zoals neon (Ne), zijn zeer stabiel en over het algemeen niet-reactief.
Ionische en covalente binding:
- Atomen kunnen stabiliteit bereiken door ionische of covalente bindingen met andere atomen te vormen.
- Ionische binding vindt plaats wanneer het ene atoom elektronen overdraagt naar het andere, wat resulteert in de vorming van positieve en negatieve ionen.
- Covalente binding vindt plaats wanneer atomen elektronen delen om hun octetschillen te voltooien.
Elektronenpaarbinding:
- Bij covalente binding worden elektronen gepaard en gedeeld tussen atomen.
- Elk elektronenpaar wordt een elektronenpaar genoemd.
- Atomen waarbij al hun valentie-elektronen gepaard zijn, zijn stabieler dan atomen met ongepaarde elektronen.
Uitzonderingen en stabiliteit:
- Er zijn uitzonderingen op de octetregel, zoals sommige overgangsmetalen en bepaalde elementen in de derde periode en daarna.
- Sommige atomen kunnen meer of minder dan acht valentie-elektronen hebben en toch stabiel zijn vanwege hun unieke elektronische configuraties of de invloed van andere factoren zoals moleculaire geometrie en bindingshoeken.
Samenvattend wordt de stabiliteit van een atoom in de eerste plaats bepaald door zijn elektronenconfiguratie, met name door het bereiken van een edelgasconfiguratie of een stabiele octetschil. Factoren zoals de rangschikking van elektronen, elektronenparen en het volgen van de octetregel spelen een cruciale rol bij het beoordelen van de stabiliteit van een atoom.
 Unieke interface en onverwacht gedrag helpen verklaren hoe zware metalen werken
Unieke interface en onverwacht gedrag helpen verklaren hoe zware metalen werken  Waarom wordt er geen puur ijzer gebruikt om gebruiksvoorwerpen te maken?
Waarom wordt er geen puur ijzer gebruikt om gebruiksvoorwerpen te maken?  Hydrogels zijn veelbelovend als een nieuwe manier om medicijnen efficiënter af te leveren
Hydrogels zijn veelbelovend als een nieuwe manier om medicijnen efficiënter af te leveren  Hoe lichtdeeltjes druppels de perfecte vloeistof kunnen produceren
Hoe lichtdeeltjes druppels de perfecte vloeistof kunnen produceren  Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren
Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren
 Biologisch afbreekbaar alternatief ter vervanging van microplastics in cosmetica en toiletartikelen
Biologisch afbreekbaar alternatief ter vervanging van microplastics in cosmetica en toiletartikelen De wind sublimeert sneeuwvlokken op Antarctica
De wind sublimeert sneeuwvlokken op Antarctica Houstons post-Harvey giftige puinhoop
Houstons post-Harvey giftige puinhoop Onderzoek identificeert hotspots van schendingen van de waterkwaliteit
Onderzoek identificeert hotspots van schendingen van de waterkwaliteit Wetenschappers ontwikkelen kader voor duurzaam beleggen
Wetenschappers ontwikkelen kader voor duurzaam beleggen
Hoofdlijnen
- Hoe MRNA van een cel te isoleren
- Wat is de term voor een organisme met chromosoomaanduiding 3n?
- Chimpansees en roetzwarte mangabeys verstoren de relaties van andere groepsleden
- Wat is euchaebacteriën?
- Onderzoekers vinden eiwit dat antibioticaresistentie kan helpen bestrijden
- Welk percentage chromosomen zou de stuifmeelkorrel hebben vergeleken met lichaamscellen van planten?
- Zoogdierhersenen identificeren type geur sneller dan ooit werd gedacht
- Wat is maïsplastic?
- Kan de evolutie verklaren waarom jongeren vaak vatbaarder zijn voor infecties dan volwassenen?
- Nieuw onderzoek toont de beperkingen van coördinatie in de chemie aan

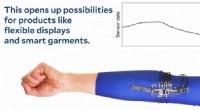
- De toekomst van elektronica is rekbaar
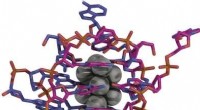
- Bepaling van de kristalstructuur van een DNA-gestabiliseerd zilveren nanocluster
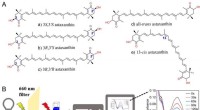
- Evaluatie van de antioxidantactiviteit van astaxanthine-isomeren tegen singletzuurstof
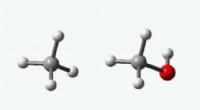
- UNT's moderne alchemist zet eerste stappen om methaan om te zetten in methanol
 Genetisch gemanipuleerde nanodeeltjes leveren dexamethason rechtstreeks aan ontstoken longen
Genetisch gemanipuleerde nanodeeltjes leveren dexamethason rechtstreeks aan ontstoken longen Een achilleshiel voor de populariteit van de Wii?
Een achilleshiel voor de populariteit van de Wii?  Grondwaterzone met put is?
Grondwaterzone met put is?  Definitie van Synoptic Weather Map
Definitie van Synoptic Weather Map Nieuwe abortuswetten worden geconfronteerd met COVID-19 en hindernissen op het gebied van middelen
Nieuwe abortuswetten worden geconfronteerd met COVID-19 en hindernissen op het gebied van middelen Hoe grootte van belang is voor katalysatoren:studielinks Grootte, Werkzaamheid, Elektronische eigenschappen
Hoe grootte van belang is voor katalysatoren:studielinks Grootte, Werkzaamheid, Elektronische eigenschappen Wetenschappers berekenen stralingsdosis in botresten van slachtoffer bomaanslag Hiroshima
Wetenschappers berekenen stralingsdosis in botresten van slachtoffer bomaanslag Hiroshima Onderzoekers gebruiken nanotechnologie om de nauwkeurigheid van meetapparatuur te verbeteren
Onderzoekers gebruiken nanotechnologie om de nauwkeurigheid van meetapparatuur te verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

