
Wetenschap
Waarom heeft benzeen een lager kookpunt maar een veel hoger smeltpunt dan tolueen?
Benzeen heeft een lager kookpunt (80,1 °C) dan tolueen (110,6 °C) vanwege zijn sterkere intermoleculaire krachten. Benzeenmoleculen worden bij elkaar gehouden door sterkere London-dispersiekrachten vergeleken met tolueen. Londense dispersiekrachten zijn tijdelijke aantrekkingen die ontstaan als gevolg van de constante beweging van elektronen binnen het molecuul.
De symmetrische elektronenverdeling in benzeen maakt een efficiënte stapeling van moleculen mogelijk, waardoor deze Londense dispersiekrachten worden gemaximaliseerd. Tolueen heeft daarentegen een methylgroep aan de benzeenring, waardoor asymmetrie ontstaat en de efficiënte stapeling wordt verstoord. De aanwezigheid van de methylgroep introduceert ook extra sterische hinder, die de dichte pakking van tolueenmoleculen verder remt. Als gevolg hiervan zijn de intermoleculaire krachten in benzeen sterker, wat leidt tot een lager kookpunt.
Hoger smeltpunt van benzeen:
Benzeen heeft een veel hoger smeltpunt (5,5 °C) vergeleken met tolueen (-95 °C) vanwege de hogere roosterenergie. In de vaste toestand zijn benzeenmoleculen gerangschikt in een zeer geordend kristallijn rooster. De sterkere Londense dispersiekrachten in benzeen dragen bij aan een stabielere en stijvere roosterstructuur.
Aan de andere kant verstoort de aanwezigheid van de methylgroep in tolueen de efficiënte stapeling van moleculen in de vaste toestand. De methylgroep belemmert de nauwe pakking en introduceert asymmetrie in de roosterstructuur, wat resulteert in zwakkere intermoleculaire krachten. Deze zwakkere roosterstructuur in tolueen leidt tot een lager smeltpunt.
Samenvattend kan het lagere kookpunt van benzeen worden toegeschreven aan de sterkere intermoleculaire krachten in de vloeibare toestand, terwijl het hogere smeltpunt een gevolg is van de sterkere roosterenergie in de vaste toestand.
 Wat klimaatverandering betekent voor bladafval
Wat klimaatverandering betekent voor bladafval  Californië bosbranden enkele van de grootste in de geschiedenis van de staat
Californië bosbranden enkele van de grootste in de geschiedenis van de staat Alpine klimroutes brokkelen af als de klimaatverandering toeslaat
Alpine klimroutes brokkelen af als de klimaatverandering toeslaat Wist je dat de aarde elke dag honderden tonnen atmosfeer aan de ruimte verliest?
Wist je dat de aarde elke dag honderden tonnen atmosfeer aan de ruimte verliest? Hoe de rivieren in de wereld veranderen
Hoe de rivieren in de wereld veranderen
Hoofdlijnen
- Wetenschappers brengen bodem-RNA in kaart met schimmelgenomen om bosecosystemen te begrijpen
- Waardoor zijn tonnen vissen omgekomen in de Europese rivier? Mysterie verdiept
- Misschien vindt u een zeldzame soort in uw achtertuin:hoe mondiale burgerwetenschap bijdraagt aan kennis over biodiversiteit
- Structuur van tarwe-immuun-eiwit opgelost:belangrijk hulpmiddel in de strijd om voedselzekerheid
- Onderzoekers identificeren hoe de bacteriële replicatieve helicase zich opent om het DNA-replicatieproces te starten
- Bloeiende onderwatertuinen gevonden voor de kust van Wellington
- De positieve effecten van genetische manipulatie
- Orka's migreren, studievondsten, maar waarom?
- In het blauw:hoe baleinwalvissen zich de afgelopen 50 miljoen jaar hebben aangepast
- Benchmarks om de zon beter te vangen

- 3D-geprinte potten in experimenten met kogelfrezen

- Wetenschappers ontwikkelen sondes die zijn ontworpen om de fysieke krachten in levende cellen te onthullen; een wereldprimeur

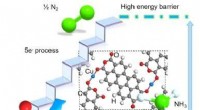
- Een nieuwe strategie voor de elektrochemische reductie van nitraat tot ammoniak
- Bij longitudinaal onderzoek gedroogde bloedvlekmonsters spelen een rol
 Bossen kappen:geen eenvoudige oplossing voor bosbranden in Californië
Bossen kappen:geen eenvoudige oplossing voor bosbranden in Californië Wat is het principe van de celmembraanstructuur van een vloeibaar mozaïekmodel?
Wat is het principe van de celmembraanstructuur van een vloeibaar mozaïekmodel?  Wat is de opwarming van de aarde?
Wat is de opwarming van de aarde?  Matige resultaten vormen een uitdaging voor HP's Whitman
Matige resultaten vormen een uitdaging voor HP's Whitman  Door zonne-energie en landbouw te combineren om klimaatverandering tegen te gaan, plattelandsgemeenschappen helpen
Door zonne-energie en landbouw te combineren om klimaatverandering tegen te gaan, plattelandsgemeenschappen helpen Waar werd het astrolabium gebruikt?
Waar werd het astrolabium gebruikt?  Hoe een Wavenumber berekenen
Hoe een Wavenumber berekenen  Maskers niet genoeg om de verspreiding van COVID-19 te stoppen zonder afstand te nemen:studie
Maskers niet genoeg om de verspreiding van COVID-19 te stoppen zonder afstand te nemen:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

