Wetenschap
Waarom zout op de weg strooien als de temperatuur tot 0 graden Celsius reikt?
Wanneer zout in water wordt opgelost, valt het uiteen in de samenstellende ionen:natrium (Na+) en chloride (Cl-). Deze ionen verstoren het bevriezingsproces van water. Normaal binden watermoleculen zich aan elkaar om kristallen te vormen bij 0 graden Celsius. De aanwezigheid van deze ionen verstoort echter het bindingsproces, waardoor een lagere temperatuur nodig is om water te laten bevriezen. Dit verlaagde vriespunt zorgt ervoor dat het ijs en de sneeuw op de weg effectief smelten.
Eutectisch vriespunt :Door de combinatie van zout en water ontstaat een oplossing met een lager eutectisch vriespunt vergeleken met zuiver water. Het eutectische punt verwijst naar de temperatuur waarbij een mengsel volledig zal smelten, zelfs in aanwezigheid van een overmaat aan vaste stoffen. Voor het zoutwatersysteem ligt het eutectische punt ongeveer -21 graden Celsius, aanzienlijk lager dan het vriespunt van zuiver water. Hierdoor blijft de oplossing zelfs onder extreem koude omstandigheden vloeibaar en effectief.
Het is belangrijk op te merken dat het gebruik van zout voor het ontdooien potentiële nadelen kan hebben. Het kan metalen aantasten en planten langs de weg beschadigen. In sommige gevallen kan overtollig zout ook een pekel vormen die in het grondwater of nabijgelegen waterlichamen sijpelt, waardoor het omringende ecosysteem wordt aangetast. Daarom moet het gebruik van alternatieve maatregelen of zoutalternatieven zorgvuldig worden overwogen om de effectiviteit van ontdooien in evenwicht te brengen met milieuoverwegingen.
 Hoe wordt haar van mannequins gemaakt?
Hoe wordt haar van mannequins gemaakt?  Welk type legeringsstructuur heeft metaalatomen van verschillende grootte?
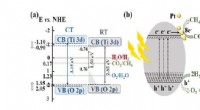
Welk type legeringsstructuur heeft metaalatomen van verschillende grootte?  Lithiumionen stromen door vast materiaal
Lithiumionen stromen door vast materiaal Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica
Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica Wat is het gas dat wordt gebruikt bij neonborden die een paarse kleur produceren?
Wat is het gas dat wordt gebruikt bij neonborden die een paarse kleur produceren?
 IJslandse studenten zien huiveringwekkende realiteit van smeltende gletsjer
IJslandse studenten zien huiveringwekkende realiteit van smeltende gletsjer Pijpleidingsexploitanten pleiten voor geen wedstrijd in olielek in Orange County en betalen bijna $ 5 miljoen
Pijpleidingsexploitanten pleiten voor geen wedstrijd in olielek in Orange County en betalen bijna $ 5 miljoen Welke economische systemen reageren het best op rampen?
Welke economische systemen reageren het best op rampen?  Houtindustrie Effect op waterverontreiniging
Houtindustrie Effect op waterverontreiniging  Het dodental door de overstromingen in Indonesië stijgt naar 43, terwijl er 15 vermist worden
Het dodental door de overstromingen in Indonesië stijgt naar 43, terwijl er 15 vermist worden
Hoofdlijnen
- Jagen op ooien met dikhoornschapen zou meer trofeerammen kunnen opleveren
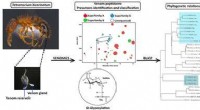
- Hoe bacteriën evolueren tot superbacteriën
- Waarom moeten bij een Gram-kleuring verse bacterieculturen worden gebruikt?
- DNA van een Incajongen die 500 jaar geleden werd geofferd, laat zien hoe mensen zich naar Zuid-Amerika verspreidden
- Wanneer verschenen mannen en vrouwen in de evolutie?
- Is het waar dat de celwand binnen het membraan ligt?
- Waar kwamen hersenen vandaan?
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Wat is de structuur van stamcellen?
 Nieuwe functie in genregulerend eiwit ontdekt
Nieuwe functie in genregulerend eiwit ontdekt Europese steden werken samen om schone energie uit te breiden en fossiele brandstoffen te verminderen
Europese steden werken samen om schone energie uit te breiden en fossiele brandstoffen te verminderen Nieuw model helpt verklaren hoe voorzieningen ziekten in het wild bevorderen of verminderen
Nieuw model helpt verklaren hoe voorzieningen ziekten in het wild bevorderen of verminderen  WeWork-oprichter Adam Neumann verwijderd van Forbes miljardairslijst
WeWork-oprichter Adam Neumann verwijderd van Forbes miljardairslijst Oude genomen uit de Andes vertonen duidelijke aanpassingen aan landbouw en hoogte
Oude genomen uit de Andes vertonen duidelijke aanpassingen aan landbouw en hoogte  Een nieuwe methode verhoogt de energie-output van windparken, zonder nieuwe apparatuur
Een nieuwe methode verhoogt de energie-output van windparken, zonder nieuwe apparatuur Stuurbare frequentie-omzetter met hoge intensiteit in de ruimtelijke modus richting on-chip-integratie
Stuurbare frequentie-omzetter met hoge intensiteit in de ruimtelijke modus richting on-chip-integratie  Suomi NPP-satelliet vangt ontwikkeling van tropische cycloon 12S
Suomi NPP-satelliet vangt ontwikkeling van tropische cycloon 12S
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com