
Wetenschap
Waarom vormt koolstof geen C4- of C4-ionen?
Deze hoge ionisatie-energie betekent dat het relatief moeilijk is om een elektron uit een koolstofatoom te verwijderen, waardoor het minder waarschijnlijk is dat er positieve ionen met een lading van 4 of hoger ontstaan. Bovendien heeft koolstof een kleine atoomstraal en een hoge elektronegativiteit, die verder bijdragen aan de stabiliteit en weerstand tegen de vorming van positieve ionen met hoge lading.
Hoewel koolstof doorgaans geen C4- of C4+-ionen vormt, kan het wel andere soorten ionen vormen, zoals carbokationen (positieve ionen met een koolstofatoom met een positieve lading) of carbanionen (negatieve ionen met een koolstofatoom met een negatieve lading).
 Engineered microbe kan de sleutel zijn tot het produceren van plastic uit planten
Engineered microbe kan de sleutel zijn tot het produceren van plastic uit planten Studie is gericht op het stimuleren van de antitumorale activiteit van een verbinding die is geëxtraheerd uit een Amazone-plant
Studie is gericht op het stimuleren van de antitumorale activiteit van een verbinding die is geëxtraheerd uit een Amazone-plant Een manier om methaan onder milde omstandigheden direct om te zetten in methanol of azijnzuur
Een manier om methaan onder milde omstandigheden direct om te zetten in methanol of azijnzuur Voordelen van gedigitaliseerd DNA delen
Voordelen van gedigitaliseerd DNA delen Chemici melden biohernieuwbaar, biologisch afbreekbaar plastic alternatief
Chemici melden biohernieuwbaar, biologisch afbreekbaar plastic alternatief
Hoofdlijnen
- Wat is een celcultuur en hoe kan deze nuttig zijn voor biologen?
- Wat voor soort cellen maakt het proces mitose en meiose?
- Nieuw onderzoek helpt de genetische basis te verklaren waarom we er zo uitzien
- Welke kleurenbuis wordt gebruikt om lipase te tekenen?
- Ouders vertonen vooringenomenheid in rivaliteit tussen broers en zussen, zegt onderzoek
- Waarom zijn er zoveel soorten kevers en weinig krokodillen?
- Wormgenomen onthullen een verband tussen mensen en verre verwanten
- Bedreigde soorten zijn sinds 2000 met 2% per jaar afgenomen:natuur positief? Verre van dat.
- Mysteriegen rijpt het skelet van de cel
- Bio-ingenieurs creëren een weg naar gepersonaliseerde geneeskunde
- De hartslag kleuren
- 'S Werelds eerste demonstratie van aanhoudende luminescentie van organische materialen, klaar om nieuwe, uitgebreid gebruik
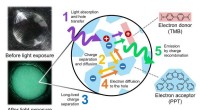
- Onderzoekers vinden een manier om farmacoterrorisme te bestrijden
- Zelfherstellend materiaal kan zichzelf opbouwen uit koolstof in de lucht

 Zijn mensen gezond genoeg om later met pensioen te gaan?
Zijn mensen gezond genoeg om later met pensioen te gaan? Netwerkaanvallen detecteren en beperken met een meervoudige aanpak
Netwerkaanvallen detecteren en beperken met een meervoudige aanpak Hoe lachgas werkt
Hoe lachgas werkt  NASA's Europa Clipper overleeft en gedijt in de ruimte op aarde
NASA's Europa Clipper overleeft en gedijt in de ruimte op aarde  Nieuwe lavastroom bedreigt nog meer gebouwen op La Palma
Nieuwe lavastroom bedreigt nog meer gebouwen op La Palma De kobaltafzettingen op aarde werden veel later gevormd dan eerder werd aangenomen
De kobaltafzettingen op aarde werden veel later gevormd dan eerder werd aangenomen Nieuwe AI ontmoet winst- en risicodoelen voor complexe financiële portefeuilles
Nieuwe AI ontmoet winst- en risicodoelen voor complexe financiële portefeuilles 3D-geprinte nanomagneten onthullen een wereld van patronen in het magnetische veld
3D-geprinte nanomagneten onthullen een wereld van patronen in het magnetische veld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

