
Wetenschap
Waarom stopt de magnesium- en zoutzuurreactie?
1. Beperkende reagens: Als een van de reactanten in een beperkte hoeveelheid aanwezig is, zal de reactie uiteindelijk stoppen wanneer die reactant is verbruikt. Als je bijvoorbeeld een klein stukje magnesium en een overmaat zoutzuur hebt, gaat de reactie door totdat al het magnesium is opgelost.
2. Concentratie: De concentratie van de reactanten kan de reactiesnelheid beïnvloeden. Hogere concentraties leiden doorgaans tot snellere reacties. Als de concentratie van magnesium of zoutzuur te laag is, kan de reactie aanzienlijk vertragen of zelfs lijken te stoppen.
3. Temperatuur: Temperatuur speelt ook een rol bij de reactiesnelheid. Hogere temperaturen versnellen gewoonlijk de reacties. Als de temperatuur te laag is, kan de reactie tussen magnesium en zoutzuur erg langzaam of zelfs onmerkbaar zijn.
4. Onzuiverheden of remmers: De aanwezigheid van onzuiverheden of remmers kan de reactie verstoren en vertragen. Als magnesium bijvoorbeeld onzuiverheden bevat die een beschermende laag op het oppervlak vormen, kan dit de reactie met zoutzuur belemmeren. Op soortgelijke wijze kunnen bepaalde verbindingen als remmers werken en de reactiesnelheid verlagen.
5. Productremming: In sommige gevallen kunnen de producten van een reactie zich ophopen en de verdere voortgang van de reactie belemmeren. Voor de reactie tussen magnesium en zoutzuur zijn de producten magnesiumchloride en waterstofgas. Als de concentratie magnesiumchloride te hoog wordt, kan dit de reactie gaan remmen.
Hoewel de reactie tussen magnesium en zoutzuur niet volledig stopt, kunnen verschillende factoren ervoor zorgen dat deze vertraagt of lijkt te stoppen. Het begrijpen van deze factoren is cruciaal voor het beheersen en optimaliseren van chemische reacties in verschillende industriële en laboratoriumomgevingen.
 Kans op hypersonische reizen neemt toe met ontdekking van nieuwe materialen
Kans op hypersonische reizen neemt toe met ontdekking van nieuwe materialen Wetenschappers creëren een chemische methode voor het in kaart brengen van de ruimte en ontrafelen het mysterie van het getal van Mendelejev
Wetenschappers creëren een chemische methode voor het in kaart brengen van de ruimte en ontrafelen het mysterie van het getal van Mendelejev Chemische reacties kunnen zowel kwantuminformatie als zwarte gaten door elkaar gooien
Chemische reacties kunnen zowel kwantuminformatie als zwarte gaten door elkaar gooien  Uit onderzoek blijkt hoe water steen molecuulsgewijs oplost
Uit onderzoek blijkt hoe water steen molecuulsgewijs oplost  Wetenschapsprojecten met Dawn Dishwashing Liquid
Wetenschapsprojecten met Dawn Dishwashing Liquid
 Passerende vliegtuigen wringen extra sneeuw en regen uit de wolken
Passerende vliegtuigen wringen extra sneeuw en regen uit de wolken Nemen we kleuren anders waar, afhankelijk van de taal die we spreken?
Nemen we kleuren anders waar, afhankelijk van de taal die we spreken?  Herziene temperatuurrecord uit het Holoceen bevestigt de rol van broeikasgassen in de afgelopen millennia
Herziene temperatuurrecord uit het Holoceen bevestigt de rol van broeikasgassen in de afgelopen millennia Twee graden opwarming kan leiden tot droogte in het Middellandse Zeegebied
Twee graden opwarming kan leiden tot droogte in het Middellandse Zeegebied Positieve effecten van overstromingen
Positieve effecten van overstromingen
Hoofdlijnen
- Welk afvalproduct wordt door het bloed uit de cellen opgenomen?
- Waarom kiezen voor biotechnologie?
- Zoete compromissen:het ontrafelen van de genetische puzzel van aardbeiensmaak en -opbrengst
- Klimaatverandering zorgt ervoor dat boompopulaties wegblijven van de bodemschimmels die hen in stand houden
- Biotechnologie en genetische manipulatie: een overzicht
- Wat is een gelachtige vloeistof waar de organellen zich bevinden?
- Hoe de uitvinding van de microscoop. Heeft wetenschappers geholpen cellen te begrijpen?
- Zien hoe evolutionaire mechanismen biologische diversiteit opleveren
- Wat gebeurt er als een kind wordt geboren met een extra chromosoom in het 23e paar?
- Handige gels maken van een eiwit dat voorkomt in menselijk bloed

- Studie volgt innerlijke werking van de hersenen met nieuwe biosensor

- Uit onderzoek blijkt dat elk haar van het menselijk lichaam kan worden gebruikt voor identificatie

- Studie onthult strategie in één stap voor het recyclen van gebruikte kernbrandstof
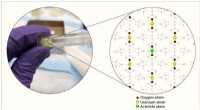
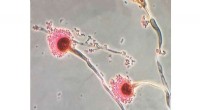
- Chemici kenmerken de dodelijke schimmel onder ons
 Juli 2019 warmste maand ooit voor planeet:NOAA
Juli 2019 warmste maand ooit voor planeet:NOAA Prototype van een hoge temperatuur warmtepomp voor het terugwinnen van industriële restwarmte
Prototype van een hoge temperatuur warmtepomp voor het terugwinnen van industriële restwarmte Opwarming van de aarde kan het dubbele zijn van wat klimaatmodellen voorspellen
Opwarming van de aarde kan het dubbele zijn van wat klimaatmodellen voorspellen Wat is de analogie van dunner?
Wat is de analogie van dunner?  Nieuwe studie legt een geheim uit voor efficiënter leren
Nieuwe studie legt een geheim uit voor efficiënter leren NASA vindt post-tropische cycloon Dolly die het tropische podium verlaat
NASA vindt post-tropische cycloon Dolly die het tropische podium verlaat Hoge geothermische temperaturen diep onder de Zuidelijke Alpen
Hoge geothermische temperaturen diep onder de Zuidelijke Alpen Klimaatverandering zorgde voor bevolkingsafname in de Nieuwe Wereld voordat de Europeanen arriveerden
Klimaatverandering zorgde voor bevolkingsafname in de Nieuwe Wereld voordat de Europeanen arriveerden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

