
Wetenschap
Waarom nemen de ionisatie-energieën van aardalkalimetalen af van Be naar Ba?
Naarmate we de elementen van groep 2 (aardalkalimetalen) van Be naar Ba afdalen, nemen de atoomstralen toe als gevolg van de toevoeging van nieuwe elektronenschillen. De grotere atoomstralen resulteren in een afname van de effectieve nucleaire lading die door de buitenste elektronen wordt ervaren. Dit betekent dat de elektronen minder sterk door de kern worden aangetrokken en gemakkelijker worden verwijderd, wat resulteert in lagere ionisatie-energieën.
Bovendien, naarmate de atoomstralen in de groep groter worden, bevinden de buitenste elektronen zich verder van de kern, waardoor het gemakkelijker wordt om ze te verwijderen.
Daarom nemen de ionisatie-energieën van aardalkalimetalen af in de groep van Be tot Ba.
 Onverwachte resultaten:schade aan Puerto Ricaanse koffieplantages door orkaan Maria gevarieerd
Onverwachte resultaten:schade aan Puerto Ricaanse koffieplantages door orkaan Maria gevarieerd Niet zo chill:Arctic beëindigt warmste winter ooit
Niet zo chill:Arctic beëindigt warmste winter ooit Mensen steken 85 procent van de bosbranden aan, en we doen vrijwel niets om het te stoppen
Mensen steken 85 procent van de bosbranden aan, en we doen vrijwel niets om het te stoppen Intensere en frequentere onweersbuien in verband met wereldwijde klimaatvariabiliteit
Intensere en frequentere onweersbuien in verband met wereldwijde klimaatvariabiliteit Microbiologische onderzoekers krijgen meer inzicht in de rol van oceanen in koolstofcycli
Microbiologische onderzoekers krijgen meer inzicht in de rol van oceanen in koolstofcycli
Hoofdlijnen
- Moet het 'extreme fokken' van teckels en Franse buldoggen verboden worden?
- Welke moleculen komen in de Krebs-cyclus en welke moleculen verlaten de Krebs-cyclus?
- Critici slaan VS over import van olifantentrofeeën
- De individuele handtekeningen onderzoeken van de kreten die hyena's maken
- Wat is de oorsprong en betekenis van naam?
- Gefixeerd op eten?
- De verschillen in broederlijke en vaderlijke tweelingen
- Onderzoek onderzoekt hoe druivenplagen bessen opsnuiven
- Marihuanaboerderijen stellen gevlekte uilen bloot aan rattengif in Noordwest-Californië
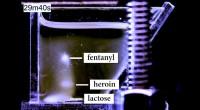
- Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
- Een filament dat geschikt is voor de ruimte - het is bewezen dat zijde gedijt bij temperaturen in de ruimte

- Warme melk maakt je slaperig - peptiden kunnen verklaren waarom

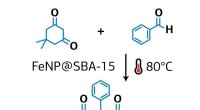
- Chemicus stelt nieuwe methode voor voor groene synthese van xantheenderivaten
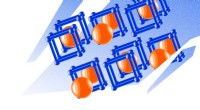
- Op de natuur geïnspireerde kristalstructuurvoorspeller
 Facebook sluit zich aan bij onderzoek naar de impact van sociale media op verkiezingen
Facebook sluit zich aan bij onderzoek naar de impact van sociale media op verkiezingen Hypothetisch gesproken:taalkundigen onderzoeken hoe de menselijke taal omgaat met sprongen vanuit het hier en nu
Hypothetisch gesproken:taalkundigen onderzoeken hoe de menselijke taal omgaat met sprongen vanuit het hier en nu  Welk zout wordt gemaakt als er zoutzuur aan het bekerglas wordt toegevoegd?
Welk zout wordt gemaakt als er zoutzuur aan het bekerglas wordt toegevoegd?  Bereken de gemiddelde temperatuur
Bereken de gemiddelde temperatuur  Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld
Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld Hydrogelbollen vormen een microporeuze structuur voor gelokaliseerde mRNA-afgifte
Hydrogelbollen vormen een microporeuze structuur voor gelokaliseerde mRNA-afgifte  Wat dacht hij? Studie wendt zich tot apenintellect
Wat dacht hij? Studie wendt zich tot apenintellect  Origami en kirigami gebruiken om herconfigureerbare maar structurele materialen te inspireren
Origami en kirigami gebruiken om herconfigureerbare maar structurele materialen te inspireren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

