
Wetenschap
Waarom zijn er voor en na de reactie hetzelfde aantal deeltjes?
Chemische reacties omvatten het verbreken van chemische bindingen in reactanten en de vorming van nieuwe chemische bindingen in producten. Tijdens deze processen worden atomen niet gecreëerd of vernietigd. Ze worden eenvoudigweg herschikt in nieuwe combinaties.
Denk bijvoorbeeld aan de verbranding van methaan:
$$\text{CH}_4 + 2\text{O}_2 \pijl naar rechts\text{CO}_2 + 2\text{H}_2\text{O}$$
Bij deze reactie reageert één molecuul methaan met twee moleculen zuurstof om één molecuul koolstofdioxide en twee moleculen water te produceren. Het aantal koolstof-, waterstof- en zuurstofatomen is aan beide kanten van de vergelijking hetzelfde:
- Koolstof:1 atoom aan beide zijden
- Waterstof:4 atomen aan beide zijden
- Zuurstof:2 atomen aan beide zijden
De wet van behoud van massa geldt voor alle chemische reacties. Het is een fundamenteel principe dat wetenschappers helpt chemische vergelijkingen in evenwicht te brengen en de stroom van atomen door reacties te volgen.
 Chemici ontdekken waarom het verzamelen van fotosynthetisch licht zo efficiënt is
Chemici ontdekken waarom het verzamelen van fotosynthetisch licht zo efficiënt is  Watermoleculen dansen in drie
Watermoleculen dansen in drie Techniek om tweecomponenten biologische sensoren te finetunen
Techniek om tweecomponenten biologische sensoren te finetunen Welke beschrijving is van toepassing op echte gassen en niet op ideale gassen?
Welke beschrijving is van toepassing op echte gassen en niet op ideale gassen?  Waardoor geeft de aanwezigheid van NH4 in de urine aan welke nieren functioneren?
Waardoor geeft de aanwezigheid van NH4 in de urine aan welke nieren functioneren?
Hoofdlijnen
- Overerving van eigenschappen van ouder op nakomelingen?
- Eerste onderzoek dat aantoont dat vogels en niet alleen zoogdieren geeuwen kopiëren
- Genotypes bepalen
- Wat is chloorflukoolstof?
- Waar staan de letters DNA voor?
- Cultuurschok:zijn in het laboratorium gekweekte cellen een betrouwbaar model voor ziekten bij de mens?
- Uit onderzoek blijkt dat harige dieven loslopen in een bos in Maine
- Waarom oudere vaders meer genetische mutaties doorgeven aan hun nakomelingen
- Een driedimensionaal tandmodel maken voor een schoolproject
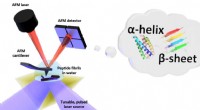
- De vorm in water:eerste nanoschaalmetingen van het vouwen van biomoleculen in vloeistof
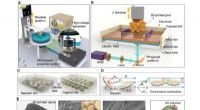
- Metaalinnovatie biedt een unieke, kosteneffectieve optie voor sanitair en productie-industrieën

- 3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden
- Smartphone-gebaseerd apparaat voor het detecteren van norovirus, de microbe van het cruiseschip

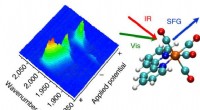
- Lasertechniek kan de deur openen naar efficiëntere schone brandstoffen
 Chinese bedrijven bieden subsidies aan voor Huawei-telefoons als blijk van steun
Chinese bedrijven bieden subsidies aan voor Huawei-telefoons als blijk van steun  Wat zijn de eigenschappen van een glas?
Wat zijn de eigenschappen van een glas?  Kunnen schoolauto's vissen hoe samen te rijden?
Kunnen schoolauto's vissen hoe samen te rijden? Kijken hoe oplaadbare lithium-ionbatterijen werken
Kijken hoe oplaadbare lithium-ionbatterijen werken Voorgeschreven brandweerlieden hebben nieuwe tools binnen handbereik
Voorgeschreven brandweerlieden hebben nieuwe tools binnen handbereik James Bond-autofabrikant Aston Martin mikt op IPO van £ 5,1 miljard
James Bond-autofabrikant Aston Martin mikt op IPO van £ 5,1 miljard Franse astronomen verkennen supercluster PLCK G334.8-38.0
Franse astronomen verkennen supercluster PLCK G334.8-38.0 Nieuwe eigenschap van polymeer kan toegankelijke zonne-energie stimuleren
Nieuwe eigenschap van polymeer kan toegankelijke zonne-energie stimuleren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

